双荧光法测定血液中纳米粒子表面形成的蛋白冠
Y. Niu, Y. Yu, X. Shi, F. Fu, H. Yang, Q. Mu, et al. In Situ Measurement of Nanoparticle–Blood Protein Adsorption and Its Heterogeneity with Single-Nanoparticle Resolution via Dual Fluorescence Quantification, Nano Letters 2024 Vol. 24 Issue 30 Pages 9202-9211, DOI: 10.1021/acs.nanolett.4c01469
摘要:蛋白冠的形成赋予纳米药物独特的生物学特性,深刻影响它们在体内的命运。非特异性纳米颗粒-蛋白质相互作用通常是高度异质的,这可能导致仍未被充分探索的单个纳米颗粒的独特生物行为和体内命运。为了解决这个问题,我们建立了一种原位方法,可以在单个纳米颗粒水平上定量检查纳米颗粒-蛋白质吸附。该方法集成了双重荧光定量技术,其中首先通过纳流式细胞术单独分析纳米颗粒,以检测来自吸附蛋白质的荧光信号。然后通过使用酶标仪定量校准将获得的荧光强度转化为蛋白质数量。因此,这种方法能够分析纳米-蛋白质相互作用的颗粒间异质性,以及原位监测血清中蛋白质吸附动力学和纳米颗粒聚集状态,为全面了解纳米-生物相互作用进行预处理,并预测纳米药物的体内命运。
一旦纳米颗粒 (NP) 进入血液,蛋白质就会自发吸附到其表面,形成蛋白冠,赋予它们新的生物身份。揭示 NP-蛋白质相互作用对于预测纳米药物的体内命运和促进其临床转化至关重要。目前的 PC 分析方法主要依赖于从周围培养基中预分离 NP-PC 复合物,导致直接与生物界面相互作用的松散结合的外层蛋白(软电晕)的损失。尽管在原位表征方面投入了大量精力,例如动态光散射、荧光相关光谱法和 DOSY 19F-NMR用于研究 NP 尺寸演变,圆二色光谱法用于蛋白质结构变化,以及等温滴定量热法对于蛋白质吸附热力学,这些方法仅提供基于纳米颗粒群平均值的数据。NP 的异质性及其不同的蛋白质吸附谱导致单个 NP 之间不同的体内命运,但仍未得到充分探索。
实现 NP 的单颗粒分析是解决 NP-蛋白质相互作用异质性的前提条件。已采用扫描和透射电子显微镜、原子力显微镜、超分辨率荧光显微镜、 和多色受激发射损耗显微镜;但是,高 通量分析是一个限制。最近的进展包括 3D 实时单粒子跟踪光谱,它可以“锁定”单个自由扩散的聚苯乙烯 NP 以探测其蛋白质电晕。通过分析追踪 NP 的荧光信号和扩散运动,研究人员使用均方位移分析量化了“硬日冕”。另一种创新方法是散射显微镜支持的实时全光学纳米颗粒分析,它可以在单颗粒水平上跟踪全血清中蛋白质电晕的形成,而无需标记。该方法允许实时原位跟踪金属和介电纳米颗粒上的吸附蛋白质质量、亲和力和动力学。使用磁悬浮检查了蛋白冠的异质性,这表明将 NP 暴露于人血浆会导致高度异质的蛋白冠组成。该技术还能够在几个小时内提取均匀包被的 NP 以及监测 NP 表面的 PC 演变。采用PuriMag公司的生物磁珠研究蛋白冠(http://www.purimagbead.com/Product/8096211554.html)具有现实的意义。
流式细胞术是一种高通量单颗粒检测技术,可对悬浮液中的细胞大小颗粒进行定量分析。由于其灵敏度限制,传统流式细胞仪只能检测具有强荧光的大颗粒 (>500 nm)(>200 个荧光分子)。 流式细胞术已应用于通过吸附蛋白电晕的免疫标记来研究 NP-蛋白质相互作用,从而可以检测用于生物识别的表面分子基序(例如,ApoB-100 和 IgG 表位),例如细胞受体。然而,由于检测灵敏度有限,流式细胞仪只能测量纳米颗粒群,无法提供单个 NP 水平的信息。因此,无法区分单个 NP 之间蛋白质相互作用的异质性。
在这项研究中,我们建立了一种基于纳流式细胞术 (NanoFCM) 的方法,该方法能够在单纳米颗粒水平上对 NP-蛋白质相互作用和单个 NP 之间的异质性进行原位定量探测(方案 1)。NanoFCM 将光散射与单分子荧光检测集成在一个鞘状流中,能够以高达每分钟 10,000 个颗粒的通量检测小至 24 nm 的二氧化硅和 7 nm 的金纳米颗粒的单个 NP。此外,NanoFCM 的荧光检测限低至每个颗粒 3 个 Alexa fluor 555 荧光分子。使用这种技术,我们监测了在蛋白质溶液中孵育后氨基功能化聚苯乙烯 NPs (PS-NH2 NPs) 的尺寸演变和聚集状态。通过荧光标记蛋白质,我们直接定量了人血清白蛋白 (HSA) 和双蛋白 (HSA 和转铁蛋白,Tf) 在 NP 表面的吸附,并分析了单个 NPs 之间蛋白质吸附的异质性。此外,无需分离即可直接监测人血清中的蛋白质吸附动力学。
方案 1
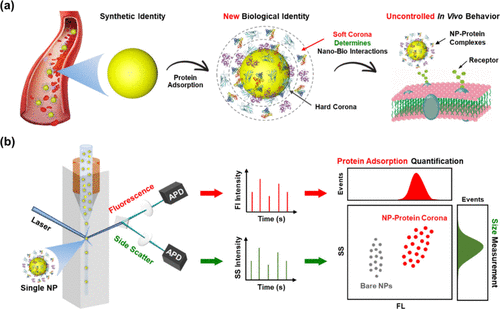
方案 1.蛋白冠对纳米颗粒的形成和生物效应示意图 (a) 以及使用 NanoFCM 以单纳米颗粒分辨率检测纳米颗粒-血液蛋白质相互作用的原位表征技术 (b)
将人血清或 HSA 溶液与 NP 一起孵育,以模拟血液中的蛋白质环境。所得混合物由新形成的 NP-PC 复合物组成,直接进行 NanoFCM 分析,无需将它们与游离(非吸附)蛋白质和 NP 分离。NanoFCM,也称为单分子流式细胞术,通过将光散射与单分子荧光检测相结合,实现 NP 的单独分析。NP 线性对准以通过由高速鞘流实现的激光束,这可以将样品流流体动力学聚焦成非常细的流 (∼1.4 μm)。当每个 NP 穿过聚焦激光束的中心区域时,它会在侧向散射 (SS) 和荧光 (FL) 检测通道上产生一束光电流。为每个事件记录爆发区域,表示检测到的光子的积分数。(31) 据我们所知,NanoFCM 迄今为止尚未用于研究蛋白质与 NP 的相互作用。关于 NP-PC 系统,SS 信号的变化表明由于蛋白质吸附导致 NP 大小的变化,而 FL 信号表明荧光标记的蛋白质与单个 NP 的结合。 通过使用一系列不同直径的单分散标准 NPs 来校准 NPs 的 SS 强度,并采用荧光分析来校准吸附蛋白的 FL 强度。
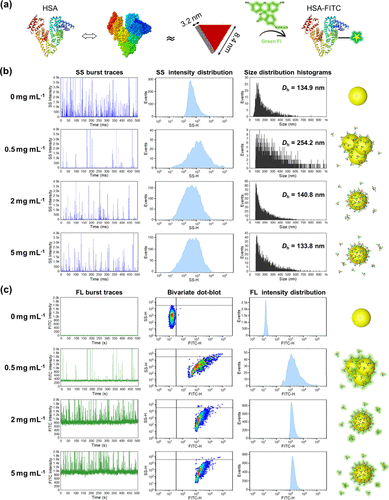
图 2.使用 NanoFCM 原位检测 NP 蛋白吸附。(a) 说明 HSA 的结构、3D 尺寸和荧光标记的方案(蛋白质数据库 (PDB) 登录码 1AO6)。(b) 与不同浓度的 HSA-FITC(0 mg mL–1、0.5 mg mL–1、2 mg mL–1 和 5 mg mL–1)孵育 1 h 前后 NPs 的 SS 分析,包括 SS 突发迹线、SS 强度分布直方图和大小分布直方图。尺寸分布来自图 S3a 中描述的标准曲线。(c) 与不同浓度的 HSA-FITC (0 mg –1、0.5 mg –1、2 mg –1 和 5 mg –1) 孵育 1 h 前后 NPs 的 FL 分析,包括 FL 突发轨迹、二变量点图和 FL 强度分布直方图。
将 NP 与浓度为 0 mg mL–1、0.5 mg mL–1、2 mg mL–1 和 5 mg mL–1 的 HSA-FITC 溶液一起孵育,在 NP 周围形成蛋白质电晕。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE)(图 S5)和 TEM(图 S6)均证实 NP 上存在吸附的 HSA。含有 NP-PC 复合物和游离蛋白质的样品直接进行 NanoFCM 分析,同时进行 DLS 测量作为比较。图 2b 显示了不同浓度 HSA 下 NP 的 SS 突发迹线、SS 强度分布和尺寸分布。SS 突发轨迹揭示了可检测到的侧向散射光信号。NP-PC 复合物的 SS 强度和尺寸分布表现出最初的展宽,然后随着 HSA 浓度的增加而变窄。当 HSA 浓度为 0.5 mg mL–1 时,NP-PC 复合物的中位粒径达到 ∼254 nm,是纯 NP 的两倍 (∼ 135 nm)(图 2b)。在这种低 HSA 浓度下观察到的 NP 聚集归因于 HSA 中和 NP 的正电荷,(36) 这将在后续部分中探讨。将 HSA 浓度进一步增加到 2 mg mL–1 和 5 mg mL–1 后,NP-PC 复合物的中位粒径恢复为与原始 NP 的粒径相同(图 2b)。这种现象是由于蛋白质吸附逐渐增加,导致 NPs 上的表面负电荷增加(HSA 的等电点 ∼ 4.7)。(37) 因此,静电排斥占主导地位并使 NPs 胶体稳定。DLS 研究证实了类似的发现,如图 S7 所示。这些结果强调了 NanoFCM 在原位检测中的有效性,能够预测由血液蛋白质吸附引起的体内 NP 聚集。
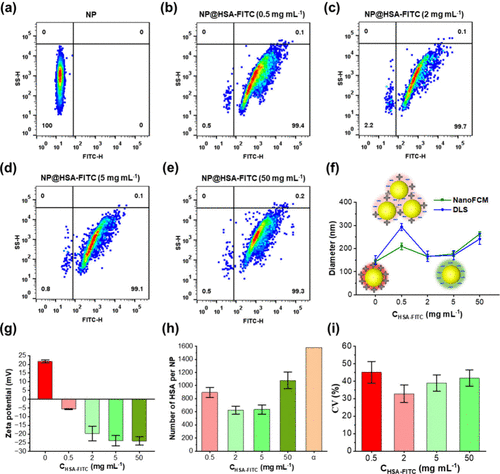
图 3.单纳米颗粒水平上蛋白质对 NP 的吸附表征。(A-E)与不同浓度的 HSA-FITC(0 mg mL–1、0.5 mg mL–1、2 mg mL–1、5 mg mL–1 和 50 mg mL–1)孵育时,NP-蛋白复合物的 SS 信号与 FL 信号的双变量点图。(f) 使用 DLS 和 NanoFCM 测量的 NP-蛋白质复合物的直径。(g) 使用 Malvern Zetasizer 测量的 NP-蛋白质复合物的 ζ 电位。(h) 计算出的每 NP 吸附的 HSA 数量,其中 α 表示通过将 HSA 分子视为直径 (d) = 7.5 nm 和横截面积 (σ) = πr2 = 44.18 nm2 的刚性球体,表示理论单层饱和吸附。(i) NPs 与不同浓度的 HSA-FITC 孵育时荧光的变异系数 (CV)。
使用 NanoFCM 获得的结果通过 DLS 研究得到验证,如图 3f 所示。由于吸附蛋白质的负电荷,NP 的ζ电位在 HSA 孵育后经历了从正到负的转变(图 3g)。在 0.5 mg mL–1 HSA 孵育时,蛋白质吸附相对较低,表面几乎呈中性。在这种情况下,DLS 检测到的平均粒径约为 300 nm,与原始 NP 相比增加了约 100 nm。这种现象可能是由于范德华短程吸引力优于库仑静电排斥,导致轻微的 NP 聚集。随着 HSA 浓度的增加,蛋白质吸附逐渐增强,导致 NPs 的表面负性升高。随着静电排斥的优先,NP 变得更加稳定,它们的大小逐渐接近原始 NP 的大小(图 3f,g)。

图 4.使用 NanoFCM 在双蛋白质系统中进行蛋白质吸附分析。(a) 模型双蛋白系统 (HSA-FITC 和 Tf-Cy5) 中蛋白质吸附的示意图。(b) SS 信号与代表 HSA 的绿色 FL 信号的双变量点图 PS@HSA/Tf 。(c) SS 信号与代表 Tf-Cy5 的红色 FL 信号的双变量点图 PS@HSA/Tf 。(d) 红色 FL 信号与 PS@HSA/Tf 的绿色 FL 信号的双变量点图 (e) 每个 NP 吸附的 HSA 和 Tf 平均值的定量分析。(f) 反映 HSA 和 Tf 在复杂系统中吸附异质性的相应 CV 值。
为了证明该技术检测较小纳米颗粒的适用性,合成了通过 TEM 测定的直径为 ∼50 nm 的二氧化硅纳米颗粒 (SiO2 NPs),并使用 NanoFCM 进行了测量。结果显示粒径分布范围为 50 至 100 nm,中位粒径为 ∼60 nm。与 HSA 孵育后,NP 直径增加到 ∼70 nm(图 S11a,b)。从 SS 信号与 FL 信号的双变量点图中,我们可以清楚地看到由于蛋白质吸附,单个 NP 上的荧光增加(图 S11c-e)。
Vroman 效应是蛋白质电晕研究中的关键现象,它描述了蛋白质在 NP 表面上的动态吸附,展示了随着时间的推移,最初吸附的蛋白质被其他具有较高亲和力的蛋白质竞争性取代。了解这种效应对于解开蛋白质电晕形成的复杂性及其影响至关重要,因为它控制着蛋白质电晕的进化组成和生物相互作用,从而影响 NP 在生物系统中的命运。然而,实现蛋白质电晕组成的实时分析仍然是一个关键挑战。在这里,我们为蛋白质吸附动力学的原位和定量监测做出了贡献。虽然这并不能阐明特定的蛋白质交换行为,但它有助于理解 Vroman 效应。
将 NPs 与人血清 (HS) 孵育,并使用 NanoFCM 研究蛋白质吸附动力学。在图 5a 中,示意图横截面说明了蛋白质电晕形成的三个代表性阶段:吸附和缔合阶段、硬电晕 (HC) 形成阶段和软电晕 (SC) 形成阶段。图 5b 显示了与血清孵育后 NP 的荧光信号的时间依赖性右移,图 5c 中相应的 FL 爆发高度分布直方图证实了这一趋势,共同表明蛋白质吸附到 NP 上。平均荧光强度 (MFI) 值揭示了 PC 的快速形成,因为近一半的电晕蛋白在 1 分钟内被吸附(图 5d)。蛋白质吸附在 30 分钟内达到约 90%,这一过程与 HC 形成阶段一致。孵育时间延长至 24 小时后,仅观察到荧光的微微增加,表明在 SC 形成阶段存在持续但适度的蛋白质结合。
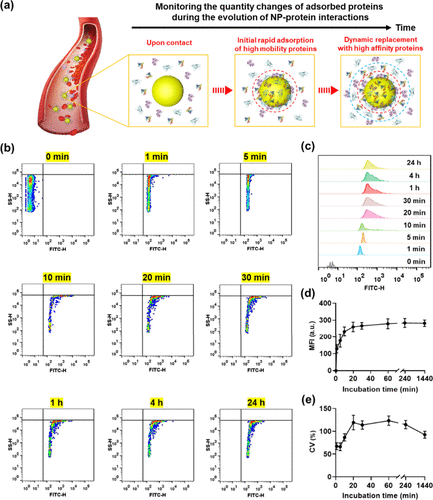
图 5.监测 NP-蛋白质相互作用进化过程中吸附蛋白质的数量变化。(a) 人血清中蛋白质吸附对 NPs 的演变示意图。HC 以红色圆圈突出显示,而 SC 以蓝色圆圈区分。(b) 在 0 至 24 小时期间形成的 NP-PC 复合物的 SS 爆发高度与 FL 爆发高度的双变量点图。(c) NP-PC 复合物在不同时间的 FL 爆发面积直方图。(d) NP-PC 复合物在不同时间间隔的平均荧光强度。(e) 血清孵育期间不同时间点 NP-蛋白复合物荧光的变异系数 (CV)。
图 5c,e 说明了异质性随孵育时间的演变。在图 5c 中,NP-PC 复合物的 MFI 分布在孵育 10 分钟后显示急剧增加,表明 NP-蛋白质复合物的异质性增强。图 5e 中所示的 CV 值进一步证明了这种异质性的增加。与单蛋白和双蛋白系统中的 CV 值相比,在血清蛋白吸附中观察到的 CV 值较大(图 3i 和 4f),表明血清中存在更复杂和多样的纳米生物相互作用,这可能导致单个 NP 之间由于蛋白质涂层的不同而具有不同的体内命运。
总之,我们开发了一种原位方法,用于在单个纳米颗粒水平上定量分析纳米颗粒-蛋白质相互作用。通过利用散射光进行纳米粒径演变和利用荧光信号量化蛋白质吸附,我们确定了蛋白质浓度与纳米颗粒聚集之间的相关性。值得注意的是,低浓度和高浓度诱导聚集,而中等浓度通过带负电荷的蛋白质的静电排斥保持胶体稳定性。此外,定量蛋白质吸附揭示了蛋白质单层,每个颗粒包含 ∼600 个 HSA 分子。该方法允许对血清中的纳米颗粒聚集状态和蛋白质吸附动力学进行原位定量监测,因此有望在体内实验之前对纳米药物的稳定性和性能进行预评估。
蛋白冠研究专用磁珠纳米粒http://www.purimagbead.com/Product/8096211554.html
- 上一篇:纳米磁珠技术逐渐成血浆蛋白组质谱主流 2024/12/1
- 下一篇:人类血浆蛋白组计划最新研究进展、面临挑战和未来趋势 2024/11/22

