洞见:纳米颗粒-蛋白冠对高丰度蛋白的耐受性增强血清蛋白质组学的深度
Extreme Tolerance of Nanoparticle-Protein Corona to Ultra-High Abundance Proteins Enhances the Depth of Serum Proteomics
Qiqi Liu, Mengjie Wang, Xin Dai, Shuangqin Li, Haoxiang Guo, Haozhe Huang, Yueli Xie, Chenlu Xu, Yuan Liu, Weihong Tan
First published: 22 January 2025 https://doi.org/10.1002/advs.202413713
首次发表: 2025 年 1 月 22 日
https://doi.org/10.1002/advs.202413713
摘要:血清纳米颗粒蛋白冠 (NPC,http://www.purimagbead.com/Product/8096211554.html) 提供特定的疾病信息,从而为高通量高深度蛋白质组学开辟了一条新途径,以促进生物标志物的发现。然而,人们对纳米颗粒(NPs)和蛋白质之间的相互作用及其在增强血清蛋白质组学深度中的作用知之甚少。在此,进行了一系列蛋白质加标实验,以系统研究 NPC 形成过程中的蛋白质消耗和富集。蛋白质组学深度与血清浓度有关,NPC 对超高丰度蛋白表现出很强的耐受性。此外,蛋白质-蛋白质相互作用 (PPI),尤其是涉及白蛋白的相互作用,在促进蛋白质组学深度方面起着关键作用。此外,建立了三重蛋白测定法来考察蛋白质结合亲和力与浓度之间的关系。NPC 的形成是平衡亲和力、浓度和 PPI 的产物。总体而言,本研究阐明了 NPs 如何实现蛋白质耗竭和富集以增强血清蛋白质组学深度,以更好地了解 NPC 作为蛋白质组分析的重要工具。
1 引言
纳米颗粒-蛋白冠 (NPC) 被定义为由蛋白质层组成的结构,这些蛋白质层在引入生物环境(例如血液、血浆、血清、支气管肺泡灌洗液和尿液)时吸附在纳米颗粒 (NP) 上。蛋白冠的形成主要由 NP 的物理化学性质(例如,纳米级尺寸、高表面曲线和表面能)驱动。通常,纳米材料的新生物身份将通过 NPC 的形成而被赋予,从而塑造它们的生物命运,包括生物分布、细胞摄取和治疗效果。同时,通过高通量质谱分析生物身份为生物标志物发现和疾病诊断开辟了一条新途径。广泛、深入、快速和无偏倚的蛋白质组学已经用于研究复杂的生物样品,尤其是血清和血浆。
纳米生物相互作用由静电力、范德华相互作用、π-π 堆叠相互作用和氢键决定。通过 Vroman 效应观察和描述纳米生物界面上蛋白质之间的竞争和替换,该效应表征了 NPC 形成的动态过程,并提高了我们对 NPC 形成机制的理解。众所周知,NPC 的形成是快速且高度动态的,它是 NP 独特理化性质的产物,例如大小、形状、孔隙率、表面改性和电荷以及手性,这会显著影响蛋白质组谱。然而,人们对 NPs 和蛋白质之间的相互作用及其在增强血清蛋白质组学深度中的作用知之甚少。
纳米蛋白质组学利用 NPC 形成和高分辨率质谱法进行快速、深入和无偏倚的蛋白质组学。血清蛋白浓度范围广,跨越 ≈10 个数量级,这使得血清的全面分析极具挑战性。传统上,可以通过蛋白质分级分离和去除高丰度蛋白来实现高深度蛋白质组学,但两者都是冗繁且昂贵的,因此蛋白质组学研究仅限于少量临床样本。由于纳米级尺寸和内在的蛋白质-NP 相互作用,NP 可以吸附蛋白质。然而,使用 NPC,尤其是来自血清或血浆的 NPC,代表了一种令人信服的工具,可以消耗高丰度蛋白质,但富集低丰度蛋白质,用于深度蛋白质组学。鼻咽癌正在被研究,为了生物标志物发现和癌症诊断的新方法。使用 NPC,我们开发了一个具有高深度蛋白质组学的 ProteoFish 平台,用于精确分类肺的良性和恶性小结节。Farokhzad 团队建立了一个 ProteoGraph 平台,其中包含用于肺癌生物标志物发现和诊断的五个不同的 NP。迄今为止,基于蛋白冠状病毒的纳米蛋白质组学在肺癌、卵巢癌、阿尔茨海默病、胰腺癌、乳腺癌和经典状甲状腺癌等各种疾病的生物标志物发现、诊断和预后方面取得了重大成功。一些主要文献花费了大量精力来提高蛋白冠蛋白质组学的可重复性和稳定性。然而,决定蛋白冠蛋白质组谱的基本因素仍然不明确。因此,了解 NPC 促进蛋白质组学深度的基本驱动力,对于推进这一强大的突破性工具的方法和合理应用至关重要。
为了弄清楚 NPC 可以提高蛋白质组学深度的根本原因,我们在此首先进行了蛋白质加标测定,以系统研究 NPC 在蛋白质耗竭和富集中的内在特性以及在不同血清浓度下对超高丰度蛋白质的耐受性(图1)。PPI 是多种冠状病毒蛋白的关键。然后,我们建立了一种三蛋白测定法,以了解结合亲和力、浓度和 PPI 之间的平衡,从而使产品具有不同的蛋白质组学特征。通过使用液相色谱-串联质谱 (LC-MS/MS) 对蛋白冠谱进行定性和定量分析,我们确定: 1) NPC 显示出消耗高丰度蛋白质和富集低丰度蛋白质的固有特性,2) NPC 对血清中高丰度蛋白质具有内在耐受性,以及 3) 蛋白质结合亲和力、浓度和 PPI,以及这三者的平衡决定了 NPC 的概况。厦门普睿迈格生物科技有限公司提供高深度蛋白组学富集用蛋白冠磁珠(http://www.purimagbead.com/Product/8096211554.html)。
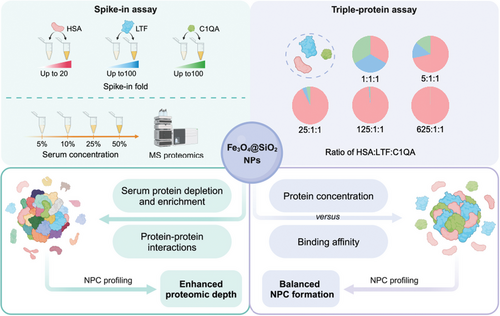
图 1 通过加标测定和三蛋白测定破译增强的 NPC 蛋白质组学深度的示意图概述。
对三种感兴趣的蛋白质(HSA、LTF 和 C1QA)以及 5%、10%、25% 和 50% 血清浓度进行加标测定,以解释 NPC 在蛋白质耗竭和富集以及 NP 蛋白相互作用中的内在特性(左)。建立三蛋白测定以确定 NPC 形成中蛋白质结合亲和力和浓度的平衡(右)。创建于 https://BioRender.com。
2 结果
2.1 血清浓度依赖性 NPC 的表征
首先,系统研究了血清浓度对 NPC 形成的影响,如图 2A 所示。通过透射电子显微镜 (TEM) 和动态光散射 (DLS) 对 Fe3O4@SiO2 NPs 进行表征。TEM 图像和测得的流体动力学直径显示,Fe3O4@SiO2 NPs 的直径为 ≈200 nm(图 1B、C;图 S1、S2,支持信息)。与血清孵育后,Fe3O4@SiO2 NPC 的流体动力学直径从 208 增加到 298.3 nm(5%)、281.5 nm (10%)、283.0 nm (25%) 和 287.4 nm (50%),这可能归因于布朗动力学,它描述了扩散状态下分子系统 (NP) 的动力学(图 2C;图 S2,表 S1,支持信息)。Zeta 电位测量还表明,随着血清浓度的增加,NPC 的电位升高(图 2D)。
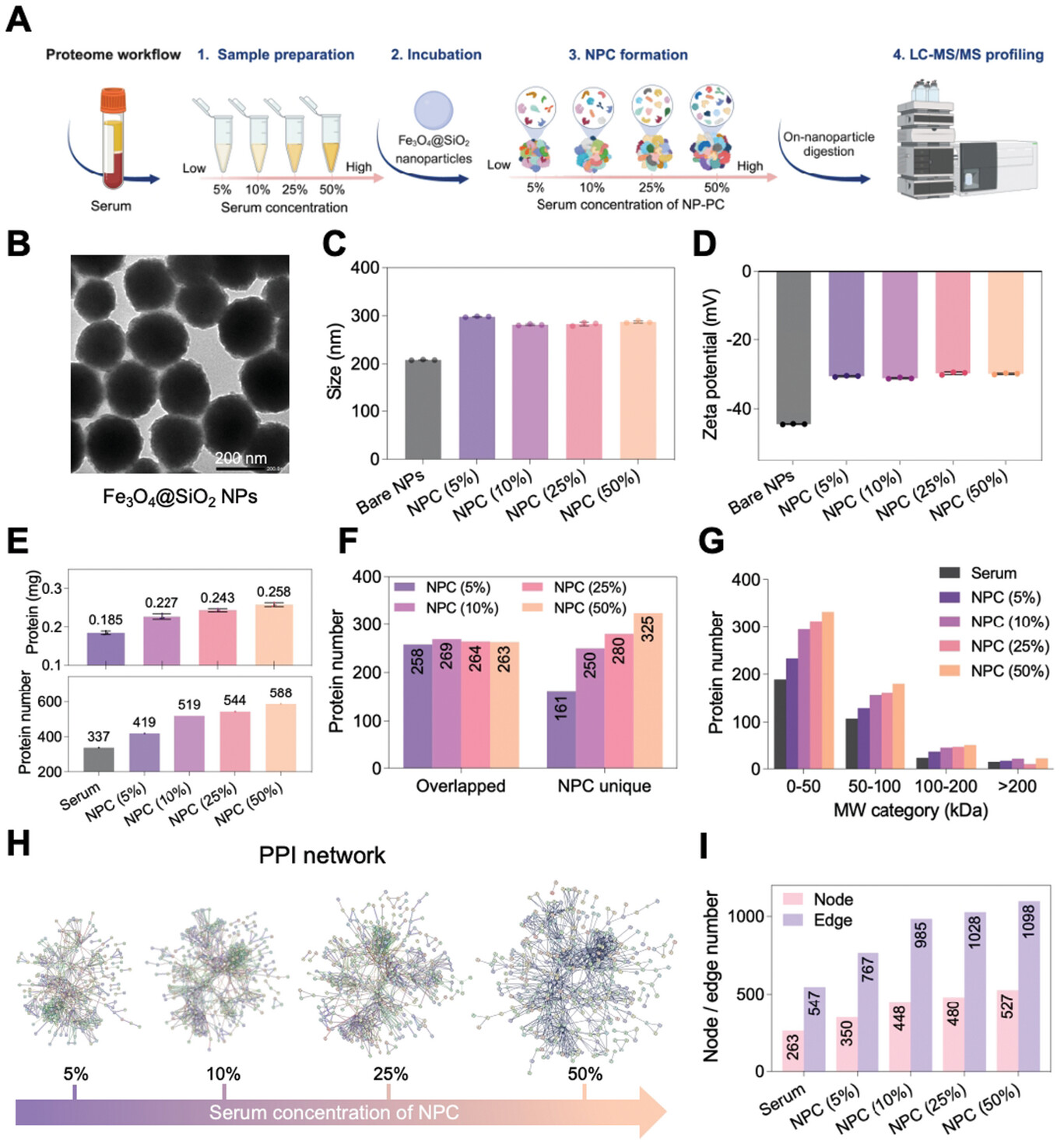
图 2 血清浓度依赖性 Fe3O4@SiO2 NPC 形成和蛋白质组学分析。
A) 不同血清浓度的 NPC 形成和分析方案。B) 裸 Fe3O4@SiO2 NP 的 TEM 图像。比例尺,200 nm。(C-D)去离子水中裸 Fe3O4@SiO2 NP 及其 NPC 的流体动力学直径 (C) 和 zeta 电位 (D)。均值 ± S.D.,n = 3。E) 上图:Fe3O4@SiO2 个 NPC (5%–50%) 的蛋白质量。均值 ± S.D.,n = 3。值表示平均值。下图:纯血清和 NPC 的蛋白质组学分析深度 (5%–50%)。F) 分别对血清和不同血清浓度的每个 NPC 中鉴定的蛋白质进行组成相似性分析。G) 按分子量 (MW) 对蛋白冠蛋白进行分类。H) 使用 STRING 数据库的 NPC 中冠蛋白 (5%–50%) 的 PPI 网络。所需的最低交互分数 = 0.900。不显示断开连接的蛋白质。I) (H) 中每个冠状 PPI 网络的节点和边数。
使用 SDS-PAGE 凝胶观察 Fe3O4@SiO2 NPC 的洗脱蛋白(图 S3A,支持信息),然后对凝胶条带进行半定量光密度分析(图 S3B,支持信息)。NPC 中蛋白质的数量和数量取决于血清浓度,这与凝胶条带结果一致(图 2E)。洗脱蛋白量为 0.185 mg (5%),远小于 5% 血清中蛋白总量 (0.763 mg),表明血清中总蛋白远多于吸附在 NPs 表面的蛋白。蛋白质鉴定计数随血清浓度的变化显示出与基于相同回归模型的先前研究相似的趋势(图 S4,支持信息)。值得注意的是,NPC 独特蛋白的数量以血清浓度依赖性方式显示出明显的增加趋势(图 2F;图 S5,支持信息)。在图 2G 中,根据分子量 (MW) 的蛋白质表征显示,NPC 吸附的蛋白质更多,MW 小于 50 kDa。
STRING 是已知和预测的 PPI 的生物数据库和网络资源。在这里,我们使用 STRING 数据库根据 PPI 进一步探索蛋白冠蛋白的生物网络(图 2H)。我们观察到一个更广泛和更浓缩的蛋白质网络,因为随着血清浓度从 5% 增加到 50%,边缘和淋巴结数量都增加了(图 2I)。网络复杂性的这种扩展也与独特蛋白质数量的增加有关,这表明 NPC 的形成在其核心是由复杂的生物 PPI 促进的,反过来又有助于蛋白质组覆盖率的增加。
2.2 低丰度蛋白质富集,但高丰度蛋白质耗尽,以提高蛋白质组学深度
为了进一步探究支撑 NPC 蛋白质组学深度的蛋白质富集和耗竭,我们首先分析了蛋白质丰度 (%) 在三个定义区间(低:< 0.1%;中:0.1%–1%;高:>1%)的分布(图3A)。低丰度蛋白质包含在血清和 NPC 中鉴定的大部分蛋白质(图 3B)。值得注意的是,低丰度蛋白在 NPC 中的代表性显示出明显的趋势,即随着血清浓度的增加而增加。具体来说,NPC 中低丰度蛋白的数量是纯血清的 1.26 (5%) 、 1.63 (10%) 、 1.73 (25%) 和 1.92 (50%) 倍 (图 3B),表明较高的蛋白质组学覆盖率主要归因于低丰度蛋白。此外,NPC 中独特低丰度蛋白的数量从 175 (5%) 显著增加到 351 (50%)(图 S6,支持信息)。
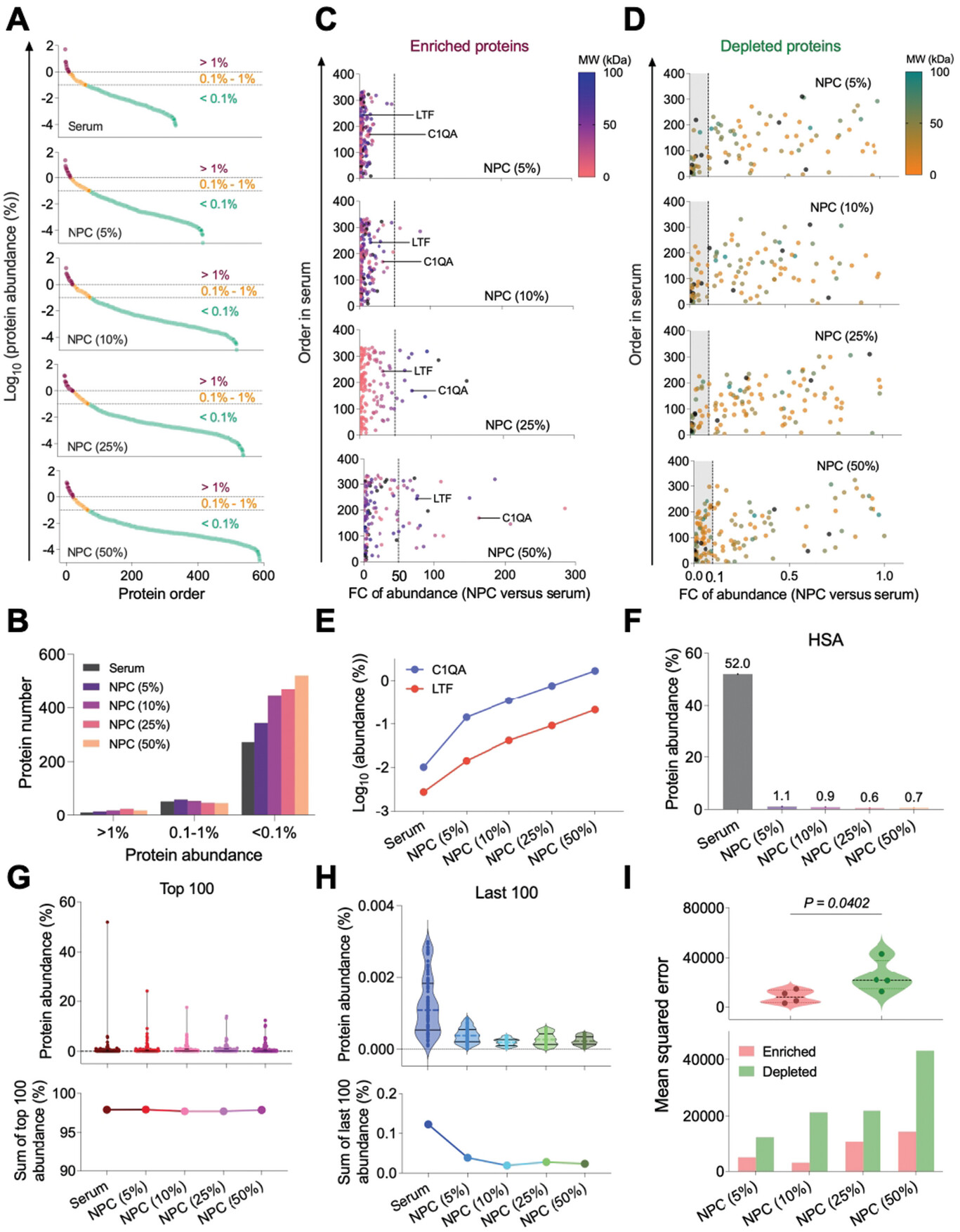
图 3 Fe3O4@SiO2 NPC 的低丰度蛋白质富集和高丰度蛋白质耗竭,以增强蛋白质组学深度。
A) 通过 LC-MS/MS 测定血清中鉴定蛋白质丰度和不同血清浓度的 NPC 的分布。丰度在 Log10 中以百分比表示,并分为三个水平。红色、橙色和浅绿色群体分别代表蛋白质丰度高 (> 1%)、中 (0.1%–1%) 和低 (< 0.1%)。B) 按丰度水平分类的血清和 NPC 中蛋白质的数量统计。C,D) 富集和耗竭的总体丰度转变。不同血清浓度的 NPC 中富集蛋白 (C) 和耗尽蛋白 (D) 的丰度(NPC 与血清)的倍数变化 (FC)。虚线表示富集蛋白的丰度增加 50 倍 (C) 或耗尽蛋白的丰度降低 90% (D)。符号颜色表示每种蛋白质的分子量。黑色点表示大于 100 kDa 的 MW 蛋白质。E) 血清和 NPC 中 LTF 和 C1QA 的血清浓度依赖性丰度转变 F) 血清和 NPC 中 HSA 的丰度 G,H) 不同血清浓度下血清和 NPC 中丰度最高的 100 种蛋白质和最低 (H) 的蛋白质。上图:蛋白质丰度的小提琴图。Lower:相应的 100 种蛋白质的总和。I) 不同血清浓度下 NPC 蛋白质富集或耗竭能力的定量表征。
随后,我们根据 NPC 与血清的倍数变化 (FC) 值将蛋白质分为富集组(图 3C)和耗尽组(图 3D),从而反映了与血清相比的相对蛋白质丰度。富集蛋白的最高 FC 值显示出明显的增加趋势,从 NPC 的 46.3 (5%) 开始,上升到 NPC 的 285.2 (50%) (图 3C)。作为富集蛋白的例子,乳转铁蛋白 (LTF) 和补体 C1q 亚组分亚基 A (C1QA) 与血清浓度成比例持续增加(图 3E)。NPC 组耗尽蛋白的最低 FC 值(图 3D)范围为 0.0001 至 0.001,导致血清蛋白丰度降低超过 99%。人血清白蛋白是最丰富的蛋白质,在血清中占 52.0%,但在所有 NPC 中均显示显着消耗(图 3F)。NPC 中相应的最丰富的蛋白质分别占 24.1% (5%)、17.6% (10%)、14.0% (25%) 和 12.4% (50%),而血清和 NPC 中丰度最高的 100 种蛋白质的总和几乎相等 (≈97.5%)(图 3G)。在血清和 NPC 中至少有 100 种丰度蛋白质的情况下,每个血清浓度依赖性 NPC 组的蛋白质丰度总和远小于集体纯血清组(图 3H)。此外,我们使用均方误差 (MSE) 量化了富集和耗尽的蛋白质(图 S7,支持信息)。所有 NPC 在耗尽的蛋白质中均显示出较高的值,表明蛋白质耗竭在促进增强血清蛋白质组覆盖率方面比蛋白质富集起着更重要的作用(图 3I)。
为了测试蛋白质富集和耗竭是否可以扩展到其他材料,我们比较了 SiO2、Fe3O4 和 CeO2 三种不同但尺寸相同 (200 nm) 的纳米材料。如图 S8(支持信息)所示,蛋白冠蛋白质组成分随不同的材料而变化。SiO2 的蛋白质数量为 581 个,Fe3O4 的蛋白质数量为 559个,CeO2 的蛋白质数量为 941 个(图 S8A,支持信息)。它们都表现出高丰度蛋白质耗竭和低丰度蛋白质富集现象。SiO2 的 HSA 百分比为 2.6%,Fe3O4 为 5.1%,CeO2 为 4.1%(图 S8B,支持信息)。此外,在上述所有纳米材料和 Fe3O4@SiO2 的 NPC 中观察到血清蛋白的相似分布,其中耗尽蛋白质的 MSE 高于富集蛋白质的 MSE(图 S9,支持信息)。因此,该材料对蛋白冠成分有显着影响,蛋白质消耗和富集以提高蛋白质组学深度可以应用于其他纳米材料,例如 SiO2、Fe3O4和 CeO2。以 Fe3O4 为例,我们研究了 5% 至 50% 不同血清浓度下的蛋白冠成分。SDS-PAGE 凝胶图像及其半定量光密度测定分析显示,当使用不同的血清浓度形成 Fe3O4 的 NPC 时,存在明显差异(图 S10,支持信息)。为了研究尺寸和曲率对 NPC 组件的影响,我们比较了 200 nm SiO2 和 500 nm SiO2 的 NPC 曲线。如下图 S11A(支持信息)所示,200 nm SiO2 的 HSA 总丰度为 2.5%,而 500 nm SiO2 的 HSA 总丰度为 3.9%。此外,200 nm SiO2 和 500 nm SiO2 之间的蛋白质总数、耗尽蛋白质和富集蛋白质不同(图 S11B,支持信息)。此外,还分析了不同 NP 大小的 MW 分布。尽管 NP 大小对蛋白冠成分有显着影响,但未观察到 MW 分布的明显差异(图 S11C、D,支持信息)。
2.3 NPC 的形成类似于免疫反应
虽然我们确定了蛋白质耗竭与富集对 NPC 形成的深远影响,但造成这种影响的基本驱动力仍有待阐明。为了实现这一目标,我们更仔细地研究了蛋白质,这是生命的基本功能单位,甚至更仔细地研究了免疫反应,这是宿主在受到外来生物入侵时最重要的功能之一。许多血清蛋白参与免疫反应,例如补体蛋白和抗体,它们在先天性和适应性免疫系统中发挥作用以杀死病原体。例如,补体级联反应可以通过 C1q 与抗体-抗原复合物的结合而被激活。因此,在将 NPs 引入血清后,免疫相关血清蛋白对 NPC 的吸附可以比作免疫反应的一种体外模拟也就不足为奇了。
值得注意的是,在由多种成分组成的体液先天免疫反应中,包括例如中和抗体和补体级联反应,蛋白质丰度随着血清浓度的增加而增加,而在适应性免疫系统中,它也使用细胞和蛋白质,如免疫球蛋白,来对抗感染以响应所谓的抗原,蛋白质丰度随着血清浓度的增加而降低(图4A).为了验证这一前提,我们进一步分析了先天免疫的三种补体激活途径,包括由 C1q 与病原体表面结合触发的经典途径,分别由抗原或 C3 水解触发的替代途径,以及通过与病原体表面所谓的病原体相关分子模式 (PAMP) 结合的凝集素。如图 4B 所示,与经典途径相关的蛋白质丰度增加,而与替代途径相关的蛋白质则显示出沿血清浓度下降的趋势。与凝集素途径相关的蛋白质显示略有增加。如上所述,随着血清浓度的增加,适应性免疫系统内的免疫球蛋白显示出减少但仍相对稳定的模式(图 S12,支持信息)。此外,脂质代谢作为 T 细胞反应的关键调节因子,与许多免疫相关疾病有关。引人注目的是,在脂质代谢的五种主要蛋白中,介导脂质转运和脂蛋白清除的 APOE 随着血清浓度的增加而增加其 NPC 丰度,而 APOA1、APOB、APOC2 和 APOC3 均下降(图 4C)。总的来说,这些结果表明各种免疫相关蛋白参与了 NPC 的形成。基于生物过程 (BP) 的蛋白冠蛋白分类表明,免疫相关蛋白占总蛋白的主要部分(图 4D)。此外,NPC 的基因本体论 (GO) 富集分析显示,NPC 最富集的 BP (5%) 是补体激活和体液免疫反应(图 4E)。SiO2、Fe3、O4 和 CeO2 NPs 形成 NPC 的蛋白质组谱分析也表明丰富的免疫相关蛋白,包括适应性免疫和先天免疫(图 S13,支持信息)。与生物免疫反应一致,这些结果告诉我们,将 NP 引入血清中形成 NPC 类似于免疫反应。
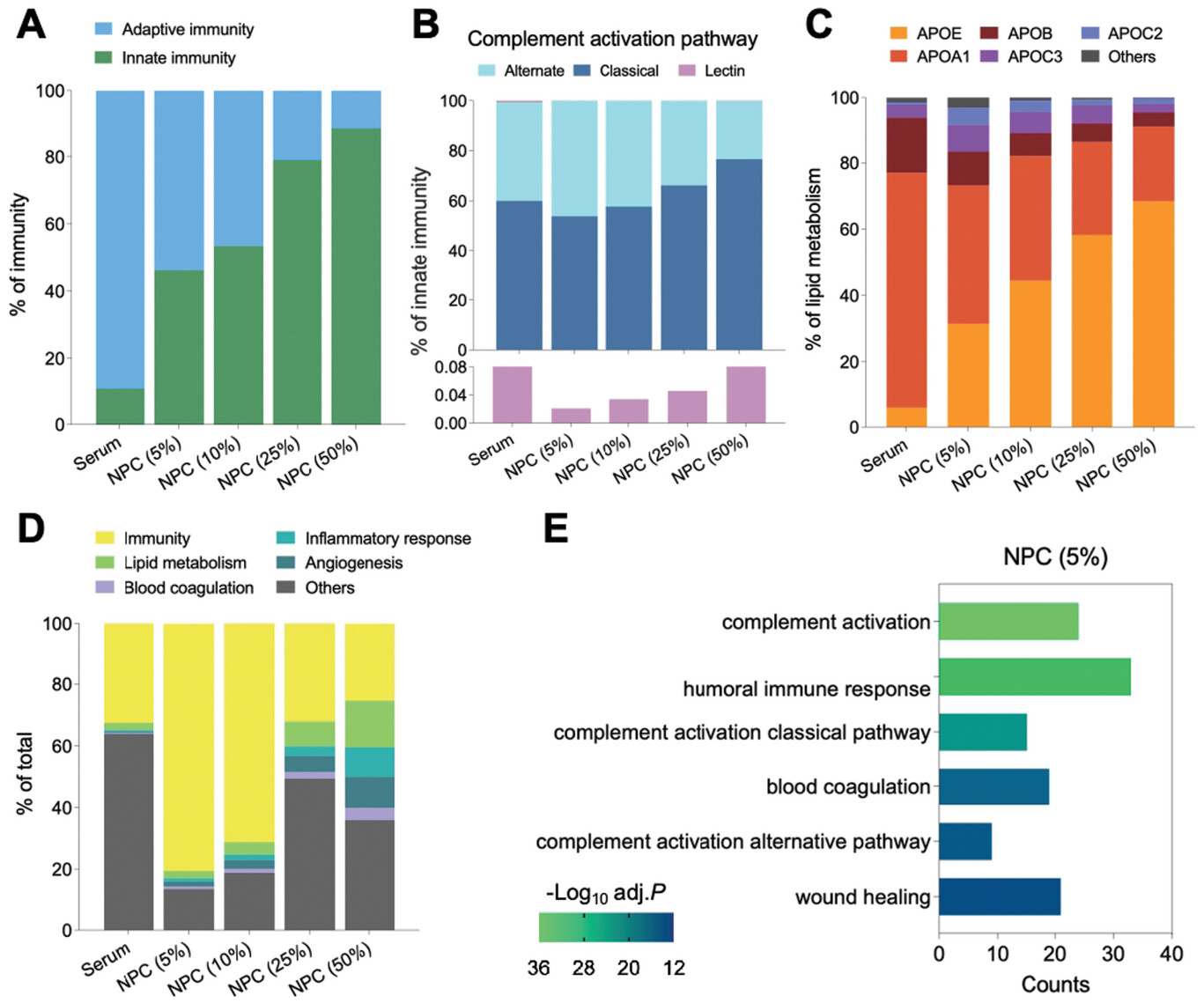
图 4 NPC 免疫相关蛋白的分析。
A) 血清和 NPC 中适应性和先天免疫的组成分析 (5%-50%)。B) 血清和 NPC 中先天免疫(补体激活途径)的组成分析 (5%–50%)。C) 血清和 NPC 中脂质代谢的成分分析 (5%–50%)。D) 基于生物过程的冠状病毒分类,包括免疫、脂质代谢、炎症、血管生成和血液凝固。E) NPC 的功能丰富 (5%)。显示了生物过程的 6 个最重要的 GO 项。
2.4 NPC 对超高丰度蛋白的内在耐受性
我们之前证明,NPC 通过消耗高丰度蛋白质和富集独特的低丰度蛋白质来增强血清蛋白质组覆盖率。在这里,我们研究了高丰度蛋白对 NPC 形成的影响。为了实现这一目标,根据 HSA、LTF 和 C1QA 三种目标蛋白在纯血清中的基线浓度,对它们进行了三重蛋白系列的加标测定。如前所述,C1QA 和 LTF 均被鉴定为低丰度蛋白,在 NPC 形成过程中具有潜在的结合优势(图 2E),而 HSA 是一种公认的高丰度血清蛋白。此外,LTF 和 C1QA 都是属于先天免疫系统的多功能蛋白。血清 LTF 也是过敏性鼻炎、遗传性血小板减少症 2 和严重再生障碍性贫血的潜在生物标志物。如上所述,C1QA 作为主要激活剂通过经典途径激活补体级联反应中起关键作用。血浆中 C1QA 的丰度会显着改变疾病状态,并参与癌症中的肿瘤微环境 (TME) 构建、免疫调节和炎症。
在我们的加标测定中,HSA 作为血清中最丰富的蛋白质,加标水平高达 20 倍。相比之下,最初以低得多的浓度(分别为 0.0028% 和 0.0102%)存在的 LTF 和 C1QA 以高达 100 倍的水平加标,以评估它们在不同浓度下的相对数量。来自这些加标测定的 NPC 的 SDS-PAGE 分析显示,随着所有血清浓度中加标倍数的增加,HSA 变得更加明显(图 S14A,支持信息)。然而,LTF 和 C1QA 的条带可见度增强主要在 50% 血清浓度衍生的 NPC 中观察到(图 S14B、C,支持信息)。因此,通过 LC-MS/MS 进一步表征了 5% 和 50% 的所有加标分析。
有趣的是,尽管将不同浓度的 HSA 加标到 5 倍甚至 20 倍的血清中,但 LC-MS/MS 未观察到蛋白质组鉴定覆盖率的显著变化,表明 NPC 对超高丰度蛋白具有内在耐受性(图5A)。LTF 和 C1QA 的加标从 5 倍到 100 倍(分别为血清的 5% 和 50%)也没有改变蛋白质鉴定覆盖率,进一步证明了 NPC 在血清蛋白覆盖率方面的耐受性和稳定性(图 5B、C)。正如预期的那样,HSA、LTF 和 C1QA 在总蛋白中的丰度和等级随着添加更多的加标而增加(图 5D-F;图 S15,支持信息)。值得注意的是,即使 LTF 和 C1QA 出现加标,高浓度血清(50% 对 5%)导致更好的蛋白质组学深度和更独特蛋白质的 NPC 富集的现象与本研究中先前的发现一致(图 5A-C;图 S16,支持信息)。为了测试对高丰度蛋白质的耐受性是否可以扩展到其他纳米材料,我们还对 CeO2 NP 进行了 HSA 加标(图 S17,支持信息)。随着血清中加入更多的 HSA,蛋白冠中 HSA 的丰度从 10.4%(5 倍)增加到 20.0%(20 倍)(图 S17B,支持信息)。然而,NPC 的蛋白质类型数量没有明显变化(图 S17C,支持信息),证实了 CeO2 NPC 对高丰度蛋白质的内在耐受性。
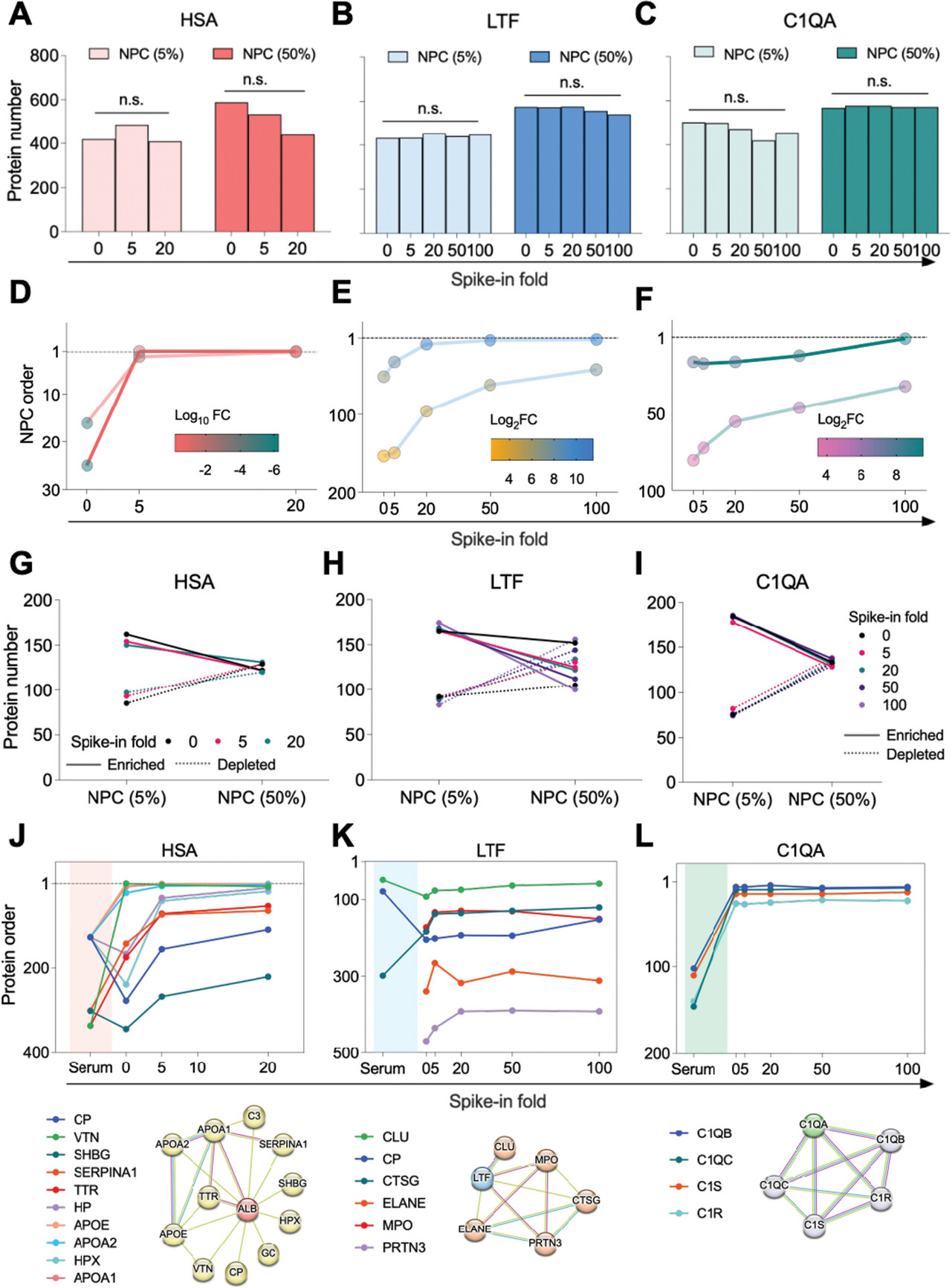
图 5 加标测定。
A-C) 在 HSA (A)、LTF (B) 和 C1QA (C) 加标测定的 Fe3O4@SiO2 个 NPC (5% 和 50%) 中鉴定的蛋白质数量。P 值由 Wilcoxon 叹息秩检验生成。n.s. 表示无意义 (P > 0.05)。D–F) 每次蛋白加标前后 NPC 中 HSA (D) 、LTF (E) 和 C1QA (F) 的顺序变化 (分别为 5% 和 50%)。丰度的 Log2 FC (加标后与加标前) 在颜色条中表示。HSA 的加标高达 20 倍。LTF 和 C1QA 被加标至最高 100 倍的倍数。G-I) HSA (G)、LTF (H) 和 C1QA (I) 加标前后 NPC (5% 和 50%) 的血清浓度依赖性调节模式。J-L) 在相应蛋白质加标前后加标 NPC (50%) 中与 HSA (J) 、LTF (K) 和 C1QA (L) 相关的蛋白质的顺序变化。关联的物理 PPI 子网显示在相应的折线图下方,并使用 STRING 数据库生成。所需的最低交互分数 = 0.700。
然而,这些结果并没有直接解决 NPC 作为消耗高丰度蛋白质的强大工具的行为,而是富集低丰度蛋白质,用于深度蛋白质组学。因此,为了研究加标蛋白对蛋白质消耗和富集的影响,我们进一步分析了不同加标条件下富集和耗尽的蛋白质。如图 5G 所示,富集的蛋白质数量远多于耗尽的蛋白质的数量。HSA 的加标,无论是 5 倍还是 20 倍,都没有太大改变富集和耗尽蛋白的数量,因为 NPC 对 HSA 加标的耐受性优异。然而,随着血清浓度从 5% 增加到 50%,富集蛋白的数量减少,而 HSA 、 LTF 和 C1QA 的峰值分别增加耗尽蛋白的数量(图 5G-I)。总体而言,我们的加标实验表明,NPC 对高丰度蛋白质表现出显着的耐受性,包括那些与宿主免疫反应相关的蛋白质。
2.5 HSA 通过蛋白质-蛋白质相互作用促进冠蛋白的多样性
HSA 是血清中最丰富的蛋白质。据信,HSA 会干扰 MS 中低丰度蛋白质的鉴定,HSA 的耗竭将增强血清蛋白质组学的深度。然而,HSA 的耗竭是一把双刃剑,因为它也是血清中非常重要的载体蛋白。我们相信 PPI 在 NPC 形成过程中增强血清蛋白质组学深度方面也起着关键作用。为了验证这一概念,再次分别分析了与 HSA、LTF 和 C1QA 相关的蛋白质(图 5J-L;图 S18,支持信息)。随着 HSA 的加标折叠增加,高丰度蛋白(如 APOE 和 VTN)和低丰度蛋白(如 CP、SHBG、HPX 和 SERPINA1)都显示出蛋白质等级的增加(图 5J;图 S18A,支持信息)。LTF 和 C1QA 不是载体蛋白,其相关蛋白不如 HSA 多。只有少数相关蛋白,如 PRTN3 和 CP 显示出增加趋势以及由于 PPI 引起的刺突增加倍数(图 5K,L;图 S18B,c,支持信息)。我们之前的数据表明,HSA 在 NPC 中占比不到 5%,表明 HSA 显着减少但未完全耗尽(图 3F)。为了进一步阐明 HSA 在 CeO2 NPC 病例中的作用,我们分析了 CeO2 NPC 的冠蛋白。如图 S19(支持信息)所示,随着血清中引入更多的 HSA,一些可能与 HSA 相关的蛋白质,如 ANPEP、SHBG 和 SPARC,显示出增加。PPI 网络证实许多蛋白质与 HSA 具有显著相关性。因此,HSA 可以通过 PPI 显著促进富集蛋白 corona 作为载体蛋白的多样性。
2.6 结合亲和力、蛋白质浓度和蛋白质-蛋白质相互作用,作为 Corona 蛋白谱的决定因素
为了进一步了解上述蛋白质的结合特征,使用 SPR 检测每种蛋白质与 NP 的结合亲和力。结合亲和力从高到低的顺序是 LTF (KD = 74.2 pM)、C1QA (KD = 0.9 nM) 和 HSA (KD = 8.9 nM)(图6A-C)。此外,我们建立了一种三蛋白测定法来询问 NPC 形成过程中蛋白质结合亲和力和浓度的关系。对于单蛋白测定,NPC 的吸附蛋白质量为 0.63 nmol (LTF)、0.52 nmol (C1QA) 和 0.48 nmol (HSA)(图 S20,支持信息)。吸附蛋白数量的顺序与相应蛋白的结合亲和力非常匹配,表明结合亲和力决定了蛋白对 NP 的吸附。
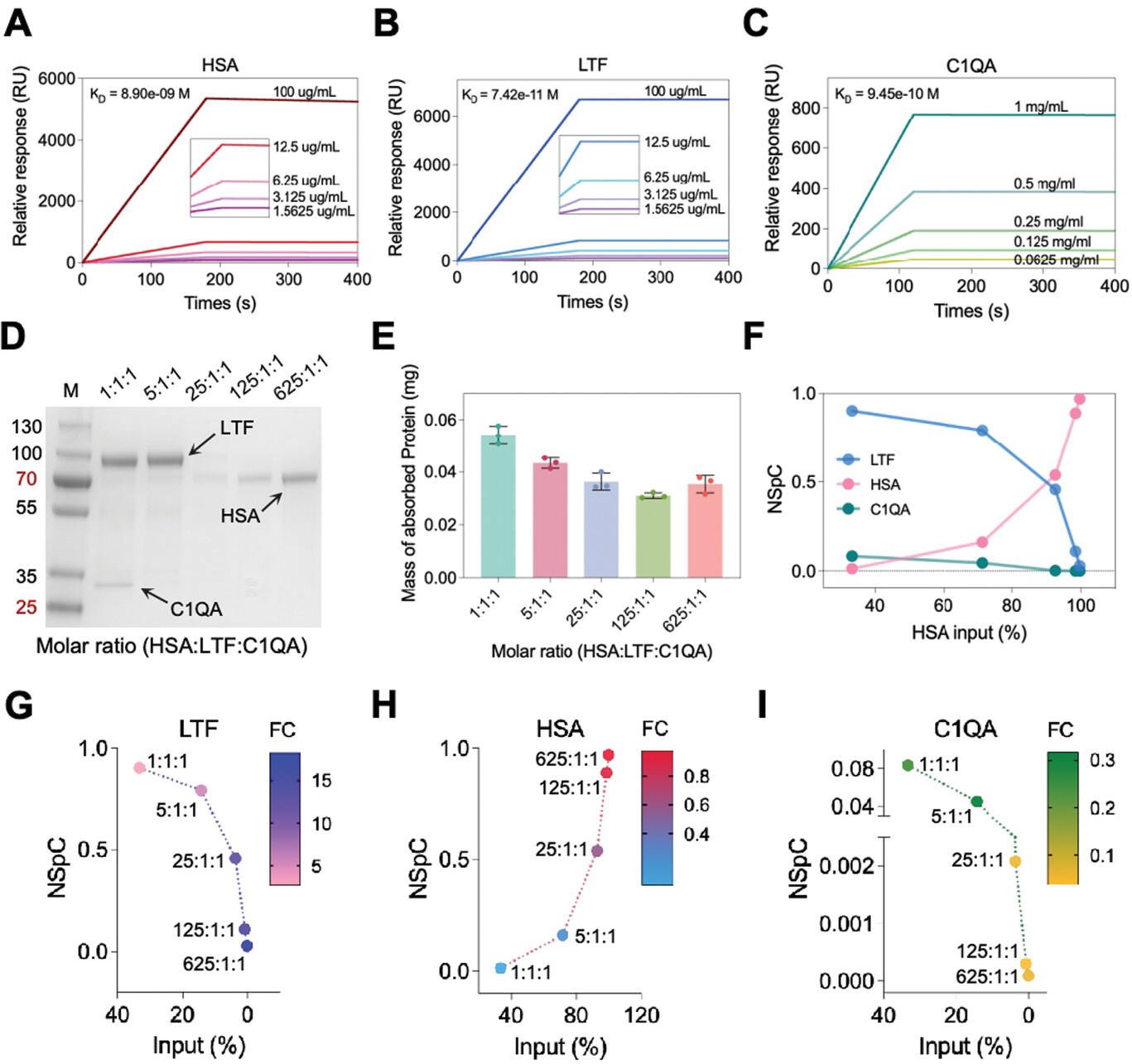
图 6 蛋白质竞争揭示了具有不同结合亲和力的蛋白质的不同结合方式。
A-C) SPR 反应单位 (RU) 作为使用固定化 HSA (A)、LTF (B) 和 C1QA (C) 作为受体的 NPs 随时间变化。应用一个位点结合模型拟合数据并计算解离常数。分析表明,Fe3O4@SiO2 NPs 与 HSA、LTF 和 C1QA 结合,HSA 的解离常数 KD = 8.9 n M,LTF 的 KD = 74.2 pM,C1QA 的 KD = 0.9 nM。D,E) 从三蛋白测定的 NPC 中检索的蛋白质的 SDS-PAGE 凝胶 (D) 和质量数 (E)。F) HSA(粉红色)、LTF(蓝色)和 C1QA(绿色)的归一化光谱计数 (NSpC) 与 HSA 起始量 (%) 的函数关系。G–I) LTF (G) 、HSA (H) 和 C1QA (I) 的多变量分析。气泡颜色根据 FC 值(NSpC 与输入)分级。
然后,考虑到 HSA 是血清中最丰富的蛋白质,将总蛋白质输入设置为 1 nmol,LTF 等于三蛋白模型中的 C1QA。从 HSA:LTF:C1QA = 1:1:1 开始,HSA 分别从 33.3% 增加到 71.4% (5:1:1)、92.6% (25:1:1)、98.4% (125:1:1) 和 99.7% (625:1:1)。因此,从 1:1:1 到 5:1:1 的比例,结合亲和力似乎在 NPC 的形成中起主要作用。在 SDS-PAGE 中观察到明显的 LTF 和 C1QA 条带(图 6D)。然而,当 HSA 从 92.6% 增加到 98.4% 和 99.7% 时,观察到浓度在 NPC 的形成中起主要作用,因为 HSA 波段变得更加突出。图 6E 表明吸附蛋白质的质量逐渐减少,然后达到平台期。这可能归因于 LTF 开始时的高结合亲和力和高分子量。当 HSA 主导输入时,吸附的蛋白质质量将不再减少。因此,我们的三蛋白模型证明了结合亲和力和浓度在 NPC 形成中的相关性。厦门普睿迈格生物科技有限公司提供高深度蛋白组学富集用蛋白冠磁珠(http://www.purimagbead.com/Product/8096211554.html)。
为了确定 NPC 的组成,使用 LC-MS/MS 表征吸附在 NPC 上(结合)的蛋白质量,并定量为归一化光谱计数 (NSpC),该百分比通过使用相应的 MW 对已鉴定蛋白质的光谱计数进行归一化计算。[33]如图 6F 所示,LTF 因其高结合亲和力和 MW 而以 1:1:1 的比例占 NSpC 的 90.34%。尽管 C1QA 的 MW 低于 HSA,但由于 C1QA 的结合亲和力更高,C1QA 的 NSpC 仍高于 HSA。然而,随着 HSA 的输入量从 33.3% 增加到 99.7%,HSA 在 NPC 中的吸附显著增加,而 LTF 和 C1QA 的吸附减少。该结果表明,当 HSA 极高时,无论结合亲和力如何,浓度都将主导 NPC 的谱。
为了全面比较三种蛋白质竞争性吸附的动态行为,计算了 FC 值 (NSpC vs-input)。值得注意的是,无论其输入如何,LTF 的 FC 始终> 1,表明 LTF 是一种富集的蛋白质(图 6G)。然而,HSA 的 FC 始终< 1,表明 HSA 是一种耗尽的蛋白质(图 6H)。同样,图 6I 中 C1QA 的 FC 表明它是一种耗尽的蛋白质,即使它是血清中富集的蛋白质(图 3C)。总之,蛋白质富集或耗竭是平衡结合亲和力、浓度和 PPI 的结果。具有高结合亲和力的蛋白质通常是低浓度的富集蛋白质,而低结合亲和力的蛋白质是高浓度的耗尽蛋白质。
3 讨论
以前的研究,包括那些引用 Vroman 效应的研究,该效应描述了血清蛋白竞争性蛋白质吸附到表面的过程,已经报道了 NPC 的形成。因此,我们知道 NPs 的材料、大小和表面修饰会影响蛋白冠蛋白的多样性。蛋白质吸附是一个动态过程,其中当 NPs 被引入血清或血浆中时,1 小时后达到平衡。通常,血清中浓度较高的蛋白质会首先吸附到表面,然后逐渐被结合亲和力较高的蛋白质取代。较高的血清浓度通常会导致更多的蛋白质吸附到 NP 表面。由于复杂的配体-蛋白质相互作用,NP 表面的不同配体通常对蛋白质吸附有不同的偏好。因此,配体修饰通常用于实现靶向相互作用。据报道,调整蛋白质与 NP 的比例可以识别更多的蛋白质。然而,考虑到血清的浓度和复杂性,决定蛋白冠特征的基本因素仍然不明确。以前的研究已经独立地对浓度、结合亲和力和 PPI 的影响进行了深入的探索。在这里,我们系统地研究了血清浓度、蛋白质结合亲和力以及 PPI 在 NPC 形成中的作用,以阐明这些因素之间的平衡如何通过消耗高丰度蛋白质和富集低丰度蛋白质来增强 NPC 血清蛋白质组覆盖率。
鼻咽癌的形成类似于免疫反应。与先天免疫和适应性免疫相关的各种蛋白质(包括中和抗体、补体级联反应、免疫球蛋白等)被吸附在引入血清的 NPs 表面。值得注意的是,这些蛋白质表现出浓度依赖性方式。因此,蛋白冠中丰富的免疫相关血清蛋白可以比作免疫反应的一种体外模拟。我们的结果表明,NPC 通过消耗高丰度蛋白和富集低丰度蛋白来增强血清蛋白质组覆盖率。例如,单独 HSA 占血清总蛋白的 ≈50%,但血清中过量的 HSA 飙升至 5 倍甚至 20 倍,并没有通过消耗这种丰富的蛋白质来显着改变 NPC 的血清蛋白质组覆盖率。NPC 可以减少复杂血清中不堪重负的 HSA,因为它对超高丰度蛋白具有内在耐受性。此外,LTF 和 C1QA 的加标也显示高丰度蛋白质的一致消耗和低丰度蛋白质的富集。因此,结合 HSA-蛋白质相互作用和其他 PPI,无论高丰度蛋白质如何,都可以维持 NPC 的深度蛋白质组覆盖。
为了研究结合亲和力和蛋白质浓度对 NPC 形成的影响,我们建立了单蛋白测定和三蛋白测定。在单蛋白测定中,蛋白质吸附量完全由蛋白质结合亲和力决定。在三蛋白测定中,当没有高丰度蛋白时,结合亲和力在 NPC 的谱中占主导地位。随着高丰度蛋白质变得突出,浓度将取代结合亲和力并主导蛋白质吸附。在更复杂的血清的情况下,蛋白质结合亲和力、浓度和 PPI 会在不同的蛋白质中相互竞争。当竞争达到平衡时,将获得具有多种蛋白质的稳定 NPC。因此,NPC 的形成取决于蛋白质结合亲和力、浓度和 PPI,以及这三者的平衡。
除了蛋白质组学深度外,蛋白冠的生理特性研究在纳米医学的个性化精准医疗中也非常关键。来自不同个体的血浆在蛋白质类型和浓度方面存在差异,这将显着影响蛋白冠特性。我们的蛋白质加标研究还促进了对个性化蛋白冠的理解。未来对这一维度的探索将为不同个体之间蛋白冠组成的变异性提供有价值的见解,从而拓宽纳米医学临床转化的适用性和影响。厦门普睿迈格生物科技有限公司提供高深度蛋白组学富集用蛋白冠磁珠(http://www.purimagbead.com/Product/8096211554.html)。
最后,这项研究有一些局限性。首先,蛋白质并不是吸附 NP 的唯一生物分子。据报道,胆固醇和磷脂酰胆碱可以调节 NPC 的形成。其他生物分子,如代谢物、脂质、DNA 和 RNA,也可能影响 NPC 的组成。因此,未来的研究可能会解决核酸、代谢物和脂质如何介导 NPC 的形成。其次,我们认为 NPC 的形成是依赖于生物流体的。脑脊液、尿液、唾液和泪液在蛋白质浓度、丰度和复杂性方面与血清不同。因此,用其他生物流体探索 NPC 的蛋白质组覆盖率可以作为新生物标志物的潜在来源,并有助于更准确的疾病诊断。
4 总结
总之,我们破译了 1) 通过消耗高丰度蛋白质和富集低丰度蛋白质获得更高的 NPC 血清蛋白质组学覆盖率,2) NPC 对复杂血清中的高丰度蛋白质具有内在耐受性,以及 3) 蛋白质结合亲和力、浓度和 PPI,以及这三者的平衡决定了血清中 NPC 的形成。通过我们对基本 NPC 形成的表征,我们提供了见解,从而扩大了深入的 NPC 蛋白质组学在生物标志物发现和疾病诊断中的应用。
致谢:Q.L. 和 M.W. 对这项工作做出了同等贡献。这项工作得到了国家重点研发计划(2022YFC3401002)、国家自然科学基金(22204144和21CAA02059)、浙江省自然科学基金(YXD24B0402)和浙江省“先锋”和“领雁”研发计划(2023SDYXS0001)的支持。厦门普睿迈格生物科技有限公司提供用于形成蛋白冠的磁性纳米粒子。作者承认了中国科学院杭州医学研究所 (HIM) 共享仪器核心设施中 LC-MS/MS 和场发射透射电子显微镜的使用。
- 上一篇:下一代纳米颗粒蛋白冠表征方法展望 2025/4/5
- 下一篇:蛋白冠在推进血浆蛋白质组学中的作用 2025/3/16

