蛋白A|Protein A 详细介绍
在生物化学和分子生物学领域,Protein A作为一种重要的工具蛋白,在抗体纯化、免疫沉淀等实验中发挥着不可或缺的作用。本文将深入探讨Protein A的来源、结构、功能、应用及其与其他相关蛋白(如Protein G和Protein A/G)的区别,旨在为读者提供一个全面而深入的理解。
关键点
- 蛋白A是从金黄色葡萄球菌中提取的一个重要抗体结合蛋白,已在抗体纯化中应用超过80年。
- 蛋白A具有较高的IgG结合亲和力,主要通过与IgG的Fc区进行非共价相互作用。
- 研究表明,工程化的蛋白A可以在更温和的条件下进行抗体纯化,减少抗体的聚合。
- 由于稳定性提升,工程化的蛋白A如Z域、C域等在不同pH环境下表现优异,适合于高样品负载的应用。
- 各种非特异性结合和杂质去除的方法已被提出,以提高抗体纯化的选择性和效率。
- 纳米颗粒(如磁性纳米颗粒)作为新的支持材料已被成功应用于蛋白A的结合和抗体的纯化。
- 蛋白A还有潜在的应用于生物传感器,用于低浓度抗体的快速检测。
由于抗体对病毒性疾病、癌症、风湿病和其他神经系统的治疗作用,它们的产生和纯化呈指数级增长。2019 年,美国食品药品监督管理局 (FDA) 批准了 PD-1 抗体和抗 EGFR mAb 等 90 种 mAb(单克隆抗体),而超过 50 种 mAb 仍处于临床试验阶段。此外,在治疗中,它可以直接附着以激活固体支持物,并用作检测抗原的敲击剂 。
抗体中的哪些功能会导致这些特性?免疫球蛋白,即 Igs,分子量约为 150 kDa,两条重链有 450-650 个氨基酸和两条轻链有 214 个氨基酸,斯托克斯半径为 4 nm,等电点在 4.0-8.6 范围内。它们由四条多肽链组成。两条相同的 50 kDa γ重链和两条相同的 25 kDa k 或 λ 轻链,可产生约 150 KDa 的蛋白质(IgG1、IgG2、IgG4 为 146 KDa,IgG3 为 170 KDa)。两条重链通过二硫键在铰链中连接:IgG1 和 IgG4 的两个键,IgG2 的 4 个键和 IgG3 的 11 个键。此外,轻链的最后一个半胱氨酸残基和重链的第五个半胱氨酸残基产生二硫键带。基于由 82-96% 蛋白质和 4-18% 碳水化合物组成的糖蛋白,人体中的五类 Ig 是 IgM、IgD、IgG、IgA 和 IgE。根据 IgG 的结构差异,将其分为四个亚类;IgG1、IgG2、IgG3 和 IgG4 在氨基酸水平上相同 90% 以上,而这些小于 10% 的差异(图 1)对它们的功能和对各种类型抗原的反应起着重要作用。值得注意的是,几乎所有已使用或未开发的抗体都使用 IgG1 亚类骨架。
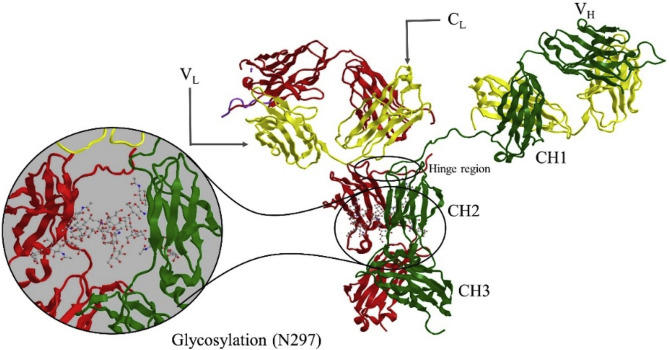
图 1.A) 四个亚类,B) IgG 及其片段的四肽链(重链;红色和绿色,轻链;黄色)。
基于 Ig结构,Ig 分为两条重链和两条轻链。重链包括 N 末端可变结构域 (VH) 和三个恒定结构域 (CH1、CH2 和 CH3),而轻链由 N 末端结构域 (VL) 和一个恒定结构域 (CL) 组成。根据结合位点,Ig 分为两部分;两个片段抗原结合位点 (Fab) 区域和一个片段可结晶 (Fc) 区域(图 1)。Fab 和 Fc 区通过二硫键连接在一起,称为柔性铰链区。Fab 作为高选择性位点与抗原结合,而 Fc 区与许多不同的蛋白质结合,例如含有新生儿 Fc 受体的细胞表面受体和细菌蛋白,如蛋白 A 和蛋白 G 。
IgG3 具有 11 个二硫键,而其他 IgG 亚类(IgG1、IgG2 和 IgG4)中只有 2-4 个二硫键。它导致 IgG3 有 13 种不同的多态性,称为同种异型,而 IgG1、IgG2 和 IgG4 分别为 4、1 和 0 种同种异型。这种差异仅导致 IgG3 与蛋白 G 或蛋白 A/G 相互作用,而不与蛋白 A 相互作用。
到目前为止,一些已发表的综述研究了用于 Ig 亲和纯化的不同种类的 Protein A,例如蛋白 A 模拟肽和工程蛋白,并比较了不同类型的市售 Protein A 基质及其性质 .纳米抗体较小的替代抗体形式,例如抗原结合片段 (Fab) 或带有末端六组氨酸标签的单链可变片段 (scFv),很容易通过固定化金属亲和色谱纯化,但以前的研究表明 His 标签对纳米抗体生物分布有负面影响。
一、Protein A的来源与结构
Protein A是一种来源于金黄色葡萄球菌(Staphylococcus aureus)的表面蛋白,其分子量约为42KDa。作为微生物来源的天然蛋白质,Protein A具有与哺乳动物的免疫球蛋白(尤其是IgG)特异性结合的能力。这一特性使得Protein A在抗体纯化、免疫沉淀等生物技术领域具有广泛的应用价值。普睿迈格提供高质量重组蛋白A(http://www.purimagbead.com/Product/6945134937.html)。
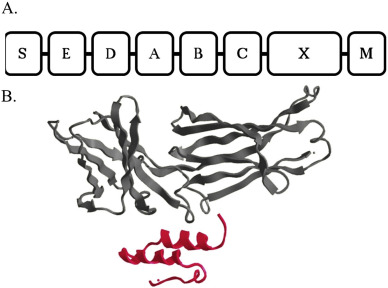
图2. A) 蛋白A基因组成包含信号序列(S)、五个IgG结合域(D、E、A、B和C)、细胞壁附着区域(XM),B) IgG Fc区的三个β转角(灰色片段,上部蛋白)与蛋白A的B域的两个α螺旋(红色片段,下部蛋白)之间的相互作用。IgG 结合结构域:E、D、A、B 和 C(每个结构域 58 个氨基酸残基)沉降在反平行的三个α螺旋中,所有结构域都显示出与 IgG 的 Fc 区亚类(IgG1、IgG2 和 IgG4)的单独相互作用,具有亲和常数,KA 为 108 (−1),对 IgG3 的亲和力非常弱。
Protein A由以下功能域组成:- 5个同源的IgG结合域(E、D、A、B、C),每个结构域均可结合IgG的Fc区域(Fahnestock et al., 1986)。
- 一个C端的细胞壁锚定结构域。
- 研究表明,其对不同物种和IgG亚类的结合效率存在差异,例如对人和兔IgG的结合能力较强,而对鼠、山羊等IgG的结合较弱(Hober et al., 2007)。
- 重组Protein A的优化
- 为克服天然Protein A与部分IgG亚类结合的局限性并提高稳定性,科研人员开发了重组Protein A(如rProtein A),通过引入点突变增强其耐碱性或改变亲和力(Jansson et al., 1998)。这些改进降低了配体脱落风险,并延长了层析介质寿命。
结构上,Protein A由多个IgG结合结构域组成,这些结构域能够特异性地识别并结合IgG的Fc区段,而与Fab区或轻链的结合则相对较弱。此外,天然的Protein A还含有一些未知功能的非Fc结合域,这些区域在Protein A与杂蛋白的结合中可能发挥一定作用,从而影响纯化后IgG的纯度。
| 蛋白质 | 尺寸 (kDa) | 目标 | 洗脱 pH |
|---|---|---|---|
| 蛋白 A | 42 | FC、Fab | 3.5 |
| 蛋白 G | 30 | Fc、Fab、ScFv | 3.2 |
| 蛋白 L | 76–106 | Fab、ScFv、κ 轻链 | 2 |
| 蛋白质 Z | 6.7 | Fc | 3.6 |
| 蛋白质 LG | 50 | Fc、κ 轻链 | 2 |
| 蛋白 LA | 60 | Fc、κ 轻链 | 2 |
| 蛋白 AG | 47.3 | Fc | 3 |
CIP 是亲和层析过程中的必要步骤,用于从纯化设备中去除聚集的蛋白质、核酸和脂质等污染物。CIP 通常以一种简单易行的方式使用浓度为 0.1 M 的氢氧化钠 (NaOH) 作为最有效的清洁剂>去除紧密结合的变性和聚集物种,并灭活大多数微生物,如细菌、病毒和内毒素 。虽然这种方法很容易使用并以低成本实现,但所有设备、蛋白质和基质都必须在高 pH 值下保持稳定。为了提高蛋白 A 在碱 pH 值的稳定性,蛋白质工程取得了成功的结果,其中最著名的是对源自 B 结构域的 Z 结构域的研究 。
Nilsson 于 1987 年根据蛋白 A 的 B 结构域的第二个结构提出了 Z 结构域的第一个概念。根据这些文章,直接参与 Fc 区和蛋白 A 相互作用的氨基酸位于每个结构域的两个螺旋上。尽管如此,研究证明,存在于结构域 E、D 和 A 中的蛋氨酸残基会增加蛋白 A 的敏感性。此外,在 28-29 位存在天冬酰胺-甘氨酸 (Asn-Gly) 对高 pH 值敏感,并且在 CIP 恶劣条件下脱氨基。该反应是自发的、依赖于水的,并因氢氧根离子而加速。因此,缺乏 Asn-Gly 和降低水分含量是可取的。
1. 纯化抗体
Protein A在抗体纯化中的应用是其最为突出的功能之一。通过将Protein A偶联于支持物(如琼脂糖、磁珠等)上,可以构建一个高效的抗体纯化系统。当含有抗体的生物样品(如血清、腹水、细胞培养液等)流经这个系统时,抗体中的Fc区段会与Protein A结合,从而实现抗体的分离和纯化。琼脂糖蛋白A磁珠请参考(http://www.purimagbead.com/Product/0293713052.html)
值得注意的是,由于Protein A与IgG的结合具有高度的特异性,因此这种方法能够高效地去除样品中的其他杂质,如血清白蛋白、细胞碎片等,从而得到高纯度的抗体。此外,通过调整偶联条件、洗脱条件等参数,还可以进一步优化纯化效果,满足不同实验需求。
2. 免疫沉淀
除了纯化抗体外,Protein A还常用于免疫沉淀实验中。免疫沉淀是一种利用抗原-抗体特异性结合原理,从复杂蛋白混合物中分离出特定蛋白的方法。在实验中,首先将特异性抗体与目标蛋白结合形成抗原-抗体复合物,然后利用Protein A与IgG的结合能力,将抗原-抗体复合物吸附到Protein A偶联的支持物上。最后,通过洗脱等步骤,可以得到纯化的目标蛋白。
免疫沉淀技术不仅可以用于研究蛋白质-蛋白质之间的相互作用,还可以用于研究蛋白质的翻译后修饰、定位等生物学特性。此外,结合质谱等高通量分析技术,免疫沉淀还可以用于蛋白质组学研究,为揭示细胞内的蛋白质网络提供有力工具。
3. 去除或减少非特异性背景
在免疫沉淀等实验中,非特异性背景的存在往往会影响实验结果的准确性和可靠性。为了降低非特异性背景,可以在实验中加入Protein A/G Beads等试剂。这些试剂能够吸附样品中的非特异性蛋白和杂质,从而降低背景干扰。同时,由于Protein A/G具有更广泛的抗体结合能力,因此还可以用于纯化那些不能与Protein A单独结合的抗体。
三、Protein A与其他相关蛋白的区别
在抗体纯化与免疫沉淀领域,除了Protein A外,还有Protein G和Protein A/G等蛋白也常被用于这些实验中。为了更全面地理解Protein A的作用和优势,我们需要将其与其他相关蛋白进行比较和分析。
1. Protein G
除了蛋白 A,还有一些关于蛋白 G 的研究,它对 IgG(所有亚型)和人血清白蛋白都有亲和力。蛋白 G 的 C 端包含三个均相 IgG 结合结构域,具有一个中央 α 螺旋和三个分子量为 11.5 kDa 的 β 折叠 。Protein G是一种来源于链球菌G族的细胞表面蛋白,也是III型Fc受体的一种。与Protein A类似,Protein G也具有与IgG特异性结合的能力。然而,与Protein A不同的是,Protein G不仅能够结合IgG的Fc区段,还能够结合Fab区段。这使得Protein G能够更广泛地结合多种类型的IgG分子,包括那些不能与Protein A结合的IgG。重组蛋白G购买请参考(http://www.purimagbead.com/Product/6093125842.html)
此外,Protein G还具有较低的血清蛋白结合水平,因此纯化得到的产物纯度较高。同时,由于Protein G的配基脱落率较低,因此在使用过程中能够保持较高的稳定性和可靠性。然而,需要注意的是,Protein G对某些特定种属的抗体(如兔抗体)的亲和力可能较低,因此在选择使用时需要根据实验需求进行权衡。
2. Protein A/G
当然,由于它与白蛋白的非特异性相互作用,已经对结构修饰进行了一些尝试,例如仅使用 IgG 结合结构域作为配体或它们与蛋白 A 结构域的偶联。Dong 及其同事成功地设计了蛋白 A 的 D 结构域与蛋白 G 的 C1 结构域的结合,其结合常数值分别比蛋白 G 和蛋白 A 高 12 倍和 8.4 倍。Protein A/G是一种兼具Protein A和Protein G特点的融合蛋白。它结合了Protein A和Protein G的结合位点,因此具有更广泛的抗体结合能力和更高的特异性。这使得Protein A/G在纯化抗体和降低非特异性背景方面表现出更优异的性能。
此外,由于Protein A/G具有更大的特异性表面区域和更多的表面抗体结合位点,因此在使用过程中能够减少非特异性结合的发生。这使得Protein A/G在免疫沉淀等实验中具有更高的灵敏度和准确性。然而,需要注意的是,由于Protein A/G结合了两种蛋白的特点,因此其制备成本可能相对较高。
四、Protein A的应用案例与注意事项
1. 应用案例
在实际应用中,Protein A已被广泛应用于各种抗体纯化、免疫沉淀等实验中。例如,在制备单克隆抗体时,可以利用Protein A偶联的磁珠从细胞培养液中快速分离和纯化抗体;在研究蛋白质相互作用时,可以利用Protein A进行免疫共沉淀实验,从而揭示蛋白质之间的相互作用网络;在疾病诊断和治疗中,可以利用Protein A纯化的抗体进行免疫组化、流式细胞术等检测手段,为疾病的诊断和治疗提供有力支持。
2. 注意事项
在使用Protein A进行抗体纯化或免疫沉淀实验时,需要注意以下几点:
- 选择合适的偶联条件:不同的偶联条件会影响Protein A与抗体的结合效率和稳定性。因此,在选择偶联条件时需要根据实验需求进行优化。
- 控制洗脱条件:洗脱条件是影响纯化效果的关键因素之一。通过调整洗脱液的pH值、离子强度等参数,可以优化洗脱效果,提高抗体的纯度和回收率。
- 避免非特异性结合:非特异性结合是影响实验结果准确性的重要因素之一。为了减少非特异性结合的发生,可以在实验中加入适量的抑制剂或进行预清除处理。
- 注意实验安全:由于Protein A来源于金黄色葡萄球菌等微生物,因此在实验过程中需要注意无菌操作和安全防护,避免实验污染和交叉感染的发生。
Protein A作为一种重要的工具蛋白,在抗体纯化、免疫沉淀等生物技术领域具有广泛的应用价值。通过深入了解Protein A的来源、结构、功能及其与其他相关蛋白的区别,我们可以更好地利用这一工具蛋白进行科学研究和技术开发。
未来,随着生物技术的不断发展和创新,Protein A的应用领域将会更加广泛和深入。例如,在抗体药物研发中,可以利用Protein A进行高效、快速的抗体筛选和纯化;在蛋白质组学研究中,可以利用Protein A进行高通量的蛋白质分离和鉴定;在疾病诊断和治疗中,可以利用Protein A纯化的抗体进行更加精准和有效的检测和治疗手段。
总之,Protein A作为一种重要的生物技术工具,将在未来的科学研究和技术创新中发挥更加重要的作用。我们相信,在不久的将来,Protein A将会为生物科学领域的发展带来更多的惊喜和突破。
- 上一篇:自动化蛋白质组样品制备:高通量和定量质谱分析的关键 2025/3/3
- 下一篇:市场主流核酸提取磁珠品牌及产品性能分析 2025/2/21

