自动化蛋白质组样品制备:高通量和定量质谱分析的关键
译名:自动化蛋白质组样品制备:高通量和定量质谱分析的关键
期刊:Mass Spectrometry Reviews
IF:10.946
发表时间:2021.10
通讯作者:Jennifer E. VanEyk
1.引言
液相色谱质谱(LC -MS)仪器的改进和生物信息学的发展,促进了基于质谱的蛋白质和肽段定量方法的发展。质谱作为基础的临床研究工具,单针可定量1000个蛋白质。血液或尿液等生物液体是一种很容易获得的样本,通过这些样本可深入了解患者的健康或疾病状况。质谱可用于识别组织或生物液体中的生物标志物,进行诊断、分期、监测或预测疾病的病理或临床结果。
开发用于临床的生物标志物需要两个阶段:发现和验证。发现阶段的特点是对患者样本进行全面分析,以开发候选生物标志物。这通常使用数据依赖型采集方法(DDA)或非数据依赖型采集(DIA)(下文讨论)来完成。在这个阶段,需要可信的定量信息。当一个或多个候选标志物已经确定,标志物需要使用更大的患者队列进行验证,以建立在临床应用中特异性和敏感性的标志物。这种方法利用了多种/选择性反应监测(M/SRM)、平行反应监测(PRM)或确定定量质谱(SQ - MS)等有靶向定量质谱方法(下文讨论)。这些方法为复杂的生物样品提供了全面和准确的肽段定量信息。
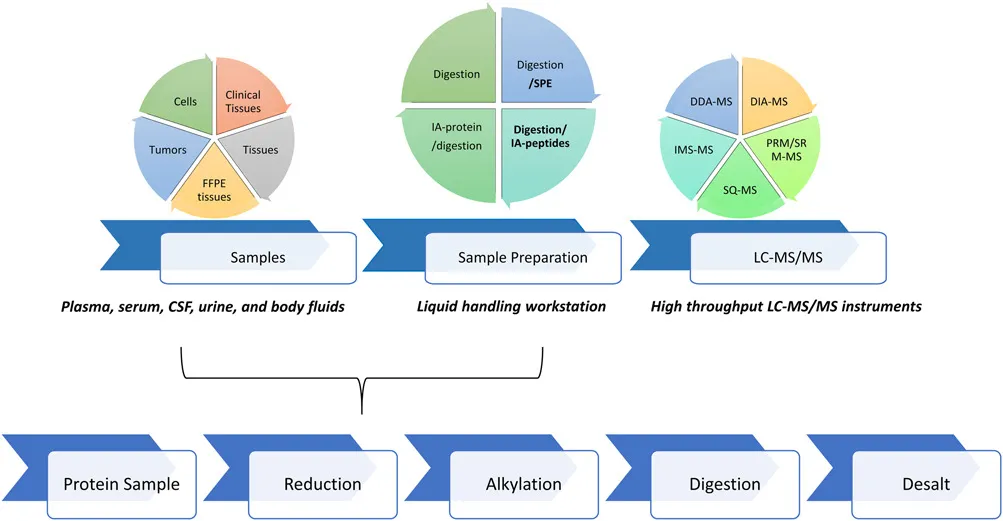
无论基于发现蛋白质组学或靶向蛋白质组学,质谱分析前基本步骤是样品制备。在质谱分析之前,蛋白质样品经过一系列步骤被消化成多肽。然而,重复性、时间和成本仍然是大规模和高通量质谱样品处理的障碍。为了解决这个问题,开发快速和准确的蛋白样品制备工作流程是必要的,从而提高检测通量,促进从生物标志物的发现到临床应用。改进样品制备的一项新型创新方法是利用自动化操作工作站,可以准确可靠地完成样品制备中复杂的流程。在接下来的章节中,我们概述了在质谱样品制备方案中自动化步骤的优化,并描述自动化在发现、验证和临床蛋白质组学工作流程中是如何实现的。
2.LC-MS样品制备的基本步骤和优化
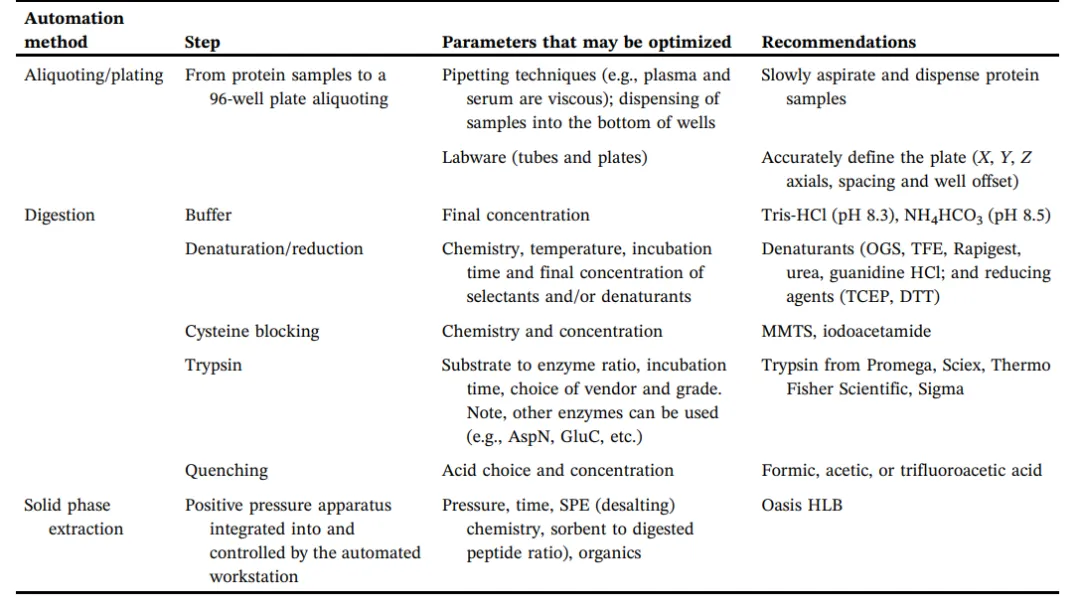
蛋白质组样品制备过程中,有几个关键的步骤,根据实验可能需要进一步优化这些步骤。步骤包括(1)蛋白质浓度测量;(2)蛋白质变性;(3)还原;(4)烷基化;(5)消化,如胰蛋白酶进行消化;(6)终止消化;(7)通过固相萃取方法脱盐,目的是以去除干扰成分(图1)。样品制备过程中的每个步骤的优化对于获得一个可靠的、可重复的定量蛋白质组学流程至关重要。临床生物标志物验证的精确度需要满足单日内和单日间的CV值小于20%。表1列出了实现预期性能和可重复性时所需的参数建议。变性剂、胰蛋白酶(或其他酶)与底物比率、缓冲液组成、孵育时间、温度等特性都应进行评估,以了解这些参数对质谱的灵敏度和蛋白质组的可靠性的影响。然后对这些参数进行手动化和自动化评估。使用自动化工作站,可以更好的实现对液体处理、混合、孵育时间和温度的控制。
2.1 蛋白质变性
蛋白质变性是消化样品的关键步骤。蛋白质二级结构打开有利于烷基化和酶切。变性有利于提高蛋白水解效率,最终提高样品制备的重复性。在蛋白质提取过程中,去垢剂被广泛使用,尤其是十二烷基硫酸钠(SDS)。然而,在随后的LC - MS/MS分析中去垢剂可能存在严重的干扰问题。其他的试剂,如尿素或胍-盐酸,也可以用来使蛋白质变性,但也会干扰质谱分析,需要在蛋白质水解后从样品中移除。在酸性条件下不稳定的去垢剂(ALS)兼容质谱,如Rapigest SF。Rapigest SF是SDS类似物,是裂解蛋白质的表面活性剂,在酸性条件下可以被分解,分解后不干扰质谱鉴定。去垢剂的成本高,因此对于大规模的队列质谱鉴定成本更高,但是一些ALSs高效实用。
Proc等人的研究发现50%(v/v)2-2-2三氟乙醇(TFE)可以用于血浆蛋白质提取,结果与SDS提取类似。许多研究表明TFE对蛋白质结构有影响,能溶解球状蛋白的疏水核心使膜蛋白变性。此外,Reiersen等人证明TFE浓度≥30%(v/v)和温度为58.6℃是最优的变性条件。TFE可以用于血液、血浆、尿液、组织和细胞的蛋白质提取。TFE的广泛应用,仪器兼容性以及挥发性的特点使其在样品制备中具有显著的优势。
2.2 还原和烷基化
变性后,蛋白质被进一步还原并烷基化,打破维持蛋白质三级结构的二硫键,并防止游离半胱氨酸再次形成二硫键。打开半胱氨酸的二硫键提高蛋白质的酶切效率和降低数据搜库的难度。还原反应通常在较高的温度下进行,还原剂主要包括二硫苏糖醇(DTT)、2-巯基乙醇(2-ME)、三(2-羧乙基)膦(TCEP)或三(3-羟丙基)膦(THPP)。烷基化使用碘乙酰胺(IAA)、丙烯酰胺(AA)、甲基甲硫磺酸盐(MMTS)、N-乙基马来酰亚胺(N -EM)或4-乙烯基吡啶(4-VP)实现。这两类试剂参与样品制备过程中的还原烷基化过程,每个反应都需要评估其完整性或副反应,副反应会改变鉴定的肽段原有的质量。Suttapitugsakul等人对还原和烷基化条件的综合评估。
2.3 酶解
自下而上的蛋白质组学需要将蛋白进行酶切然后进行数据库搜索。胰蛋白酶由于酶切的特异性(在赖氨酸和精氨酸残基之后)和较高的酶活,因此是蛋白质组学实验中最常用的蛋白酶。用胰蛋白酶消化产生大小为500-5000Da的肽段且有好的蛋白覆盖率。其他几种蛋白酶都有各自的特异性,如胰凝乳蛋白酶、Glu-C、Asp-N或蛋白酶K。蛋白酶可以单独使用或与胰蛋白酶联合使用增加酶切位点,提高序列覆盖度。对于任何蛋白质水解,有效的消化取决于优化酶与蛋白质的比例、温度和温度。
之前的研究表明,蛋白质酶切步骤是LC-MS分析中不稳定性的主要来源。不稳定性的主要驱动因素之一是大多数蛋白质组固有的复杂性。人类蛋白质组来源于2万多个基因,同一个基因产生多个异构体以及多翻译后修饰(PTMs)等。蛋白质异构体在时间和空间上调控个体的生理或病理状态(图2)。蛋白质浓度有大的动态范围,在一个样品中,高丰度的蛋白比低丰度蛋白高出10个数量级。为了获得最优的人体血浆酶切效率,研究14种不同的蛋白质变性条件。不同基质(血浆、血清、脑脊液[CSF]和其他蛋白质组样品)的蛋白裂解是复杂的,每个蛋白都有各自的三级、四级结构和酶切位点。检测外源添加细菌蛋白β-半乳糖苷酶(β‐gal)发现171份人类血浆样本处理的变异系数(CV)在18%-25%。使用两种蛋白质(外源性β-gal和内源性人血清白蛋白)作为自动消化监测的代表性分析物,白蛋白和β-gal的峰值面积比(天然/稳定同位素标记[SIL]肽信号)在优化前分别为30%CV和20%CV。优化自动化工作站后,内源性人血清白蛋白和外源添加的β-gal蛋白的CV分别达到3%和4%-8%(图3)。
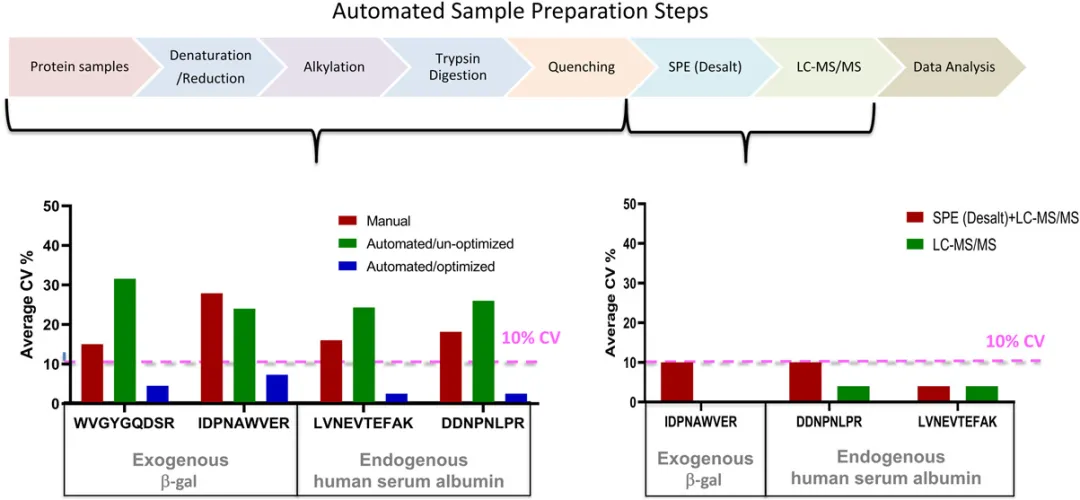
左图为三种不同消化条件的CV%如图所示:手动消化(红色)、未优化的自动消化(绿色)和优化的自动消化(蓝色)。重现性用面积比(轻标/重标SIL)和CV值进行评估,CV值是通过β-gal酶切肽段加入到健康的人血浆来评估(4-8个重复)。血浆样品变性、还原、烷基化并用胰蛋白酶消化。平均面积比CV% β-gal和轻标的峰面积(轻标/重标SIL)计算人血清白蛋白。MRM数据采用6500QTRAP采集。右图显示自动固相萃取(24孔)的CV%。β-gal和人血清白蛋白SIL多肽加入酶切后的健康人的血浆样品中,用整合i7自动控制装置工作站的正压装置脱盐。脱盐后SIL重标肽信号计算CV%。MRM数据同样由LC‐MS获得。CV %是从7次重复注射中计算出来。SIL,稳定同位素标记。
2.4.终止
消化后,在酸性条件下终止反应,酸化的肽段进行脱盐。常用的几种挥发性酸:甲酸、乙酸或三氟乙酸。在18O标记的情况下,酶切终止有利于防止胰蛋白酶介导的重标反向交换。
2.5 脱盐
用高分辨率质谱仪(如Orbitrap、TripleTOF或TimsTOF)分析肽段需要进行脱盐,实现去除污染物并浓缩肽段的目的。通常使用C18树脂特异性地结合多肽去除污染物。固相萃取可以通过手动真空提取或正压装置来实现(手动或自动)。手动调解真空影响重现性,建议使用正压装置。在自动化的工作站上整合正压除盐装置。采用集成的自动化正压装置,压力由氮气调节,流速和时间根据样品和溶剂类型预先编程,从而实现回收产物的均一性和可重复性。
最近出现了一些创新步骤,将样品制备步骤整合到一个独立的柱或枪尖上。S-trap利用多孔材料捕获变性的蛋白质溶液,去除污染物,对蛋白质进行还原、烷基化和消化。这种方法在样品制备过程中有效的去除污染物和表面活性剂。Chen等人提出并扩展了类似的方法,集成的旋转枪尖蛋白质组学技术(SISPROT)利用强阳离子交换珠和C18树脂,实现样品消化等步骤,包括最终脱盐完全整合到单个枪尖上,从而实现快速,高灵敏度,样品损失小的优点。该方法与一些翻译后修饰的富集兼容。在自动化的流程中,样品制备的一体化和简化很重要。
开发自动化流程进一步考虑是试剂的选择,试剂应该具备可分装的特点从而减少试剂的批量化效应。在96孔板里,外源蛋白β-半乳糖可用于质量控制监测自动蛋白质组学样品制备工作流程的再现性和准确性。在还原和烷基化反应之前加入β-半乳糖蛋白及其相应SIL肽标准的混合物。建立优化的自动化工作流程,评估几天内的重现性很重要。对于标准化自动化工作流程,同时需要在多个实验室进行重复。
3.定量质谱法
样品准备完成后,使用高性能质谱技术分析样品进行疾病生物标志物的发现或验证研究。基于发现蛋白质组学,通常使用数据依赖型采集(DDA-MS)或非数据依赖型采集(DIA-MS)方法提供生物样本定量评估。在DDA-MS中,所有前体离子在一级扫描期间被扫描(MS1),然后选择一些离子进行碎裂,产生一系列串联质谱(MS/MS或MS2)。所有的谱图在数据库中进行搜索,匹配到肽段和蛋白质。DDA是针对前N个母离子(设定特定数量的前体离子且信号高于“噪声”)进行采样,碎裂产生二级谱图,所以影响低丰度肽和蛋白质的定量和定性。
在DIA-MS中,定义的质荷比(m/z)窗口内所有前体离子都可能碎裂。碎片离子在特定的隔离窗口中积累。由于所有检测到的前体离子都可以被碎裂,所以DIA-MS的优势在于能够准确定量,而不受DDA-MS前体离子碎裂数量的限制。DIA-MS方法需要产生高分辨率二级谱图的质谱仪。
除了发现标志物,还需要在大量患者样本中有针对性的验证。目前,验证的方法有多反应监测质谱(MRM-MS),也被称为选择性反应监测质谱(SRM-MS),平行反应监测质谱(PRM-MS),以及Sure-Quant质谱法(SQ-MS)。Sure-Quant质谱法(SQ-MS)可对体液、穿刺样本或培养细胞的肽段中特定的肽段进行精确定量。SRM-MS利用高重复性三重四极杆(QqQ)质谱仪选择肽段进行定量分析。SRM-MS的优势在于肽/蛋白定量的选择性、敏感性和多重性。PRM-MS是一种类似SRM的靶向方法,需要高分辨率和高质量精度(HR/AM)的质谱仪进行二级谱图采集。多肽和蛋白质定量具有高度的选择性和特异性。SQ-MS是最近开发的一种利用HR/AM Orbitrap质谱仪靶向采集方法。用动态变化的质谱参数监测样品中的参考内标。该方法提高了内源性肽定量的数据质量并且可以实现大量靶点肽段的定量。
4. 实现自动蛋白质组学样品制备
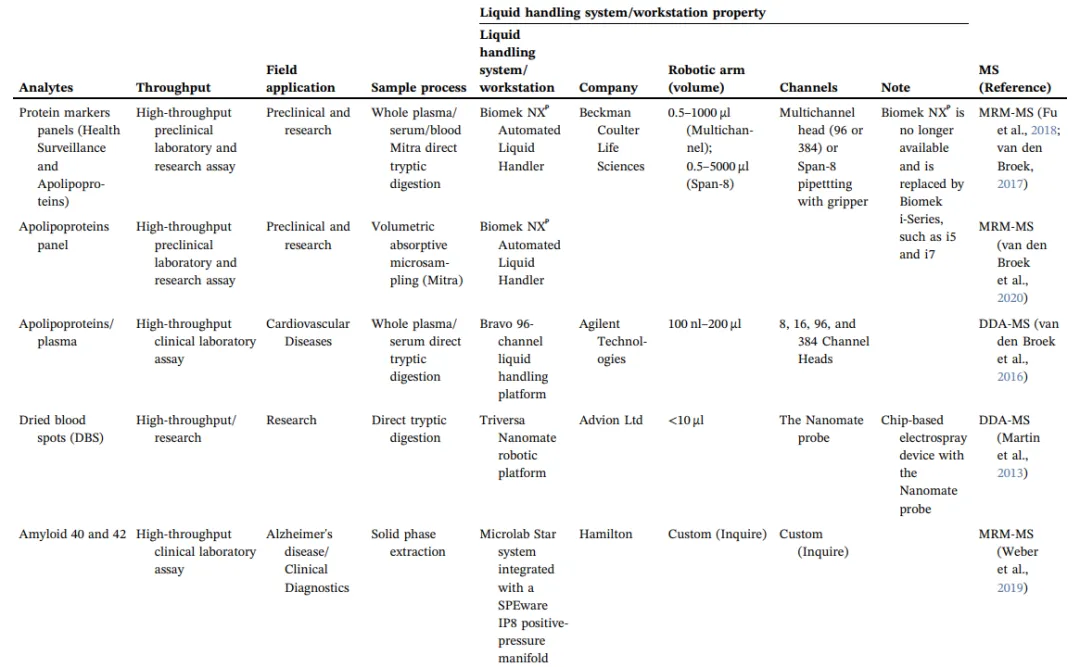
蛋白质组学实验的成功与否很大程度上取决于样品制备的速度和质量。在样品制备流程中通过自动化的工作站提高样品通量和准确度。自动化工作站需要以下功能:(1)在精确的时间里控制液体转移,(2)从试剂瓶/盘中转移液体到酶解盘,(3)96/364针和/或8跨度的头,(4)移动酶解盘,(5)温度和时间控制的容器可以震动,(6)一个独立的平板摇床,用作搅拌机。这些特点使人类的双手从重复和劳动密集的步骤中解放出来,并提高大量样品的准确性和重现性。在文献中,越来越多的例子表明,在高通量临床、病理、制药和研究领域利用自动化工作站进行蛋白质组学样品制备(表2)。下面的部分描述了几个关键的研究,以及自动化工作流程的性能。
4.1 直接消化‐质谱
生物液体,如血浆、血清、CSF、尿液以及血液,包括Whatman收集纸收集的干的血液或体积吸收微采样(VAMS)收集到的干的血液,这些生物液体是复杂的基质,有丰富的蛋白质组信息。在临床前和临床研究中,有几项研究利用自动化工作站开发了蛋白质消化和定量质谱分析的自动化工作流程(表2)。直接消化是样品制备最简单的形式,不需要从细胞或组织中提取特定的物质或特定的富集/去除步骤。例如,Biomek NXᴾ(贝克曼库尔特有限公司)的自动化工作流程直从Mitra(一种体积吸收微采样设备)消化干燥血液,Mitra结合高流速LC和灵敏的三重四级杆质谱仪,利用MRM方法实现高精度地定量高丰度蛋白(CV<20%)。在另一项研究中,Bravo(安捷伦)96通道液体处理器用于处理干血滴(DBS),结合高流速LC-MS定量肽段,如载脂蛋白A-I,B, C-II C-III和E,利用MRM的技术实现CV<6%。另一项研究使用Tecan Freedom液体处理自动化工作站对来自DBS样品的97种血液蛋白进行定量,每条肽的样品内重复和样品间重复CV<12%(包括MS CV)。
4.2 固相萃取
这个工作流程已经在临床实验室实现,Quest Diagnostics报告了一种高通量MS分析确定CSF中β-淀粉样蛋白中1-42(A42)与β-淀粉样蛋白1-40 (A40)的比例,诊断和区分阿尔茨海默病患者和健康对照者。CSF胰蛋白酶消化后采用基于汉密尔顿自动化液体处理程序的固相萃取自动化工作流程完成。我们团队已经使用i7混合液体处理工作站的正压装置脱盐。液体处理%CV为6%左右(包括脱盐步骤时,总%CV为~10%;未脱盐总%CV约为4%)(图3右下图)。
4.3 质量控制
单克隆抗体(mABs)治疗已迅速成为各种疾病治疗的重要治疗手段,包括癌症、慢性炎症和病理性感染。最近,美国食品和药物管理局(FDA)已批准使用单克隆抗体治疗COVID-19。对于生物制药行业来说,监测mAB的质量控制至关重要,包括重组序列验证。实验室使用自动样品制备方法对单抗质量控制进行研究,该方法使用KingFisher液体处理工作站(赛默飞)通过质谱方法匹配mAB多肽。该团队还使用相同的自动化流程进行了实验室间研究,以证明mAB产品质量控制的一致性。
4.4 免疫亲和富集和去除
血液蛋白质组(和由此产生的血浆和血清亚蛋白质组)的蛋白质浓度范围跨度大;~1010个蛋白质,浓度跨度从mg/ml到pg/ml。高丰度的蛋白抑制了低丰度蛋白的检测。为了提高低峰度蛋白的灵敏度,免疫亲和(IA)方法成功地应用于自动样品制备。例如,Lassman等人使用特异性抗体富集低丰度的血浆胆甾醇酯转移蛋白(CEPT)和Kexin样前转化酶枯草杆菌蛋白酶家族的第9个成员(PSCK9),使用优化的自动化IA程序(Freedom EVO, Tecan Trading)在不到3周的时间内对1400份血浆样本分析,实现样品内和样品间的CV低于15%。
在免疫捕获工作流程中,使用稳定同位素标准和抗肽抗体捕获(SISCAPA或免疫MRM [iMRM])。进行蛋白水解,捕获带有特异性抗体的肽段,通过质谱进行检测和定量,iMRM测定临床蛋白(>10分析物),如胱抑素C, C反应蛋白,载脂蛋白E,载脂蛋白CIII和其他蛋白质。血浆、血清和DBSs都可以用iMRM分析。多个自动化工作站和平台成功使用iMRM方法分析血浆生物标志物,如Bravo自动液体处理器(安捷伦),KingFisher磁粒子处理器(赛默飞),和汉密尔顿液体处理工作站(汉密尔顿)。这些液体处理工作站表明自动化可以实现快速胰蛋白酶消化和免疫捕获且单日内和单日间的CV值均小于10%。
此外,iMRM抗肽抗体捕获的一个优点是酶切后暴露了不易接触的表位。因此,iMRM可以在降低干扰的同时对临床上血浆生物标志物进行定量。例如,甲状腺球蛋白,循环肿瘤标记物作为标志物评估甲状腺癌治疗有效性,抗甲状腺球蛋白自动化抗体的缺失阻碍抗原决定簇鉴定假阴性结果。因此,开发了一种自动iMRM分析样品制备流程来测量特定的甲状腺球蛋白酶切后肽段。血浆蛋白经胰蛋白酶消化后,采用自动液体处理工作站(来自Eppendorf的epMotion)利用特异性抗体选择性富集甲状腺球蛋白特异性肽。富集后,用质谱检测内源性甲状腺球蛋白肽和标肽,该方法能够满足临床诊断所需的标准(CV < 20%)。
4.5 从细胞或组织中提取蛋白质
与体液样品处理相比,细胞、肿瘤或组织的蛋白水解消化的自动化工作站需要额外的处理步骤。主要步骤包括组织或肿瘤破碎、细胞裂解、DNA剪切和蛋白质提取、蛋白质变性和消化步骤。最近,Müller等人开发了一种方法,整合了自适应聚焦声学技术(AFA)和单点固相增强样品制备(SP3,磁珠参考http://www.purimagbead.com/Product/1736805216.html)在液体处理工作站上,用96孔板自动处理组织裂解物。AFA超声是一种先进的声学技术,可以通过96孔板聚焦超声对样品进行机械加工。SP3利用磁珠在有机溶剂(>50% ACN或EtOH)下促进蛋白质结合到珠子上的原理,再清洗磁珠去除污染物和去垢剂。工作流程实现全程自动化细胞或组织样品制备。最近报道的SP2工作流程(一种羧酸修饰顺磁粒子的替代适应性,利用液体处理程序(epMotion工作站,Eppendorf)进行肽分离)可以有效去除污染物(洗涤剂和盐)以及在质谱鉴定前除盐步骤(Waas等人,2019)。
4.6 COVID-19
COVID-19大流行体现将自动样本制备应用到临床实验室的必要性和紧迫性。大流行加速了临床实验室对快速、准确的自动RNA检测的需求。最近,发表了一些使用质谱技术在临床实验室进行COVID-19相关筛查的报告。Cardozo等人开发了一种自动化制备样品的方法并结合高通量靶向LC-MS/MS方法,检测鼻和咽拭子中的SARS-Cov-2核蛋白肽。96个样品的自动酶解可以在4小时内完成,LC/MS每10分钟运行4个样品,每天可分析500个样品。另一项研究利用PRM-MS对COVID-19刺突糖蛋白和核蛋白进行检测,通过基于免疫亲和的富集和溶液酶解的自动化样品制备。采用PRM-MS的采集模式进行采集,检测COVID - 19刺突糖蛋白和核蛋白。
5.临床蛋白质组学中的自动化-未来展望
除了蛋白质酶切自动化,样品制备的其他步骤自动化也有优点。例如,自动收集样品(条形码和验证)进行分块、存储和存档,简化大型临床队列的管理。运送和装载样品到样品制备工作站的自动化消除许多耗时和容易出错的步骤。全自动化的发展将包括高质量、预先包装的、即用型的试剂的标准化。自动化技术、液体处理、质谱分析、数据处理和出报告整个流程缩短时间和成本,同时提高后续分析的可靠性和精度。磁珠法在蛋白质组学样品前处理上具有广泛用途(如SP3磁珠、蛋白冠磁珠等。)
质谱技术的快速发展与各种自动化样品制备工作流程相结合,将在常规临床实验室中变得普遍。高分辨率、高精确的质谱仪器有利于多个样本的分析。目前,自动样品制备方法可用于发现蛋白质组学(DDA-MS,DIA-MS)和靶向蛋白质组学(PRM-MS;MRM/SRM-MS, SQ-MS)。然而,自动化工具和工作流程需要灵活应对新的质谱方法。结合自动化样品制备和高通量、高特异性和高灵敏度的LC-MS/MS检测方法是蛋白质组学技术从基础研究领域走向临床实验室和精准医学的关键。
评估生物材料的一个基本要求是将其细化到分析。在蛋白质组学中,自动化样本采集对于提高生物标志物发现、验证、临床前、临床和药物研究中蛋白质的一致性和定量准确性至关重要。在常规临床实验室中,需要开发和优化精确度高、重现性高和稳定好的样品制备流程。在实现高通量基础上不断改进蛋白质组学样品制备的自动化技术是将质谱和蛋白质组学整合到个性化药物的关键。
原文链接:
https://pubmed.ncbi.nlm.nih.gov/34786750/
- 上一篇:蛋白质冷冻解冻过程中的结构变化对活性影响的关键机制分析 2025/3/6
- 下一篇:蛋白A|Protein A 详细介绍 2025/2/22

