血液蛋白质组的检测深度——如何看待不同的策略方案?
根据WHO疾病分类组织(international classification of disease, ICD)的统计,人类疾病的种类超过14500种,血浆/血清作为临床检验最重要的样本,具有无创易获得、安全性高、蛋白分子含量丰富等特点,可反映出机体生理和病理状态,在疾病早期诊断、预后指导等生物标志物研究方面具有重要的研究价值。血液是人体的体液库,血液中的血浆组分(Plasma)中包含了来自人体各个组织和器官的信息分子(DNA、RNA、蛋白质和代谢物等),通过血液循环实现远距离的信息传递和调控。血浆信息分子中,蛋白质的种类(>1万种)和复杂度(cSNP(单氨基酸改变)、isoform(可变剪接体编码产物)、PTM(翻译后修饰))远超其它分子类型。因为蛋白质是生命体的功能分子和执行者,血浆蛋白质组(Plasma Proteome)的动态变化直接指针人体生理和病理的变化;此外,血浆组分稳定,易于获取,对患者的创伤小等诸多优点,使得从血浆中筛选与人体生理和病理相关联的蛋白质分子标志物(Biomarker)成为长久以来的研究热点。
随着质谱技术的发展,基于质谱的深度血液蛋白质组学正逐渐成为血液蛋白质的科研利器,在肿瘤研究,免疫疾病,心血管代谢性疾病,生殖领域等均为不可或缺的研究工具。但血液样本的特殊性为蛋白组学的分析带来了巨大的技术挑战。
01. 血液样本特殊在哪?
为什么说血液样本在蛋白组学研究中具有巨大的技术挑战及取得的成果非常局限?这主要是由血液样本的特殊性决定,那接下来我们就一起看看血液样本到底特殊在哪?
构成血液蛋白组的蛋白质可分为三类:
1)第一类:在血液中具有功能的蛋白质,包括血清白蛋白(HSA),大约占总蛋白的50%;载脂蛋白,在脂质运输和内稳态中起着关键作用;先天免疫反应的急性期蛋白及凝血级联反应的蛋白。
2)第二类:在循环中的组织渗漏蛋白,如天冬氨酸转氨酶(ASAT)和丙氨酸转氨酶(ALAT)等,用于肝脏疾病的诊断。
3)第三类:信号分子,如小蛋白激素(胰岛素)及细胞因子,这类蛋白在稳态下通常有很低的丰度。比如:IL-6的基线水平为5 pg/mL,而较为丰富的白蛋白(HSA)约为50 mg/mL。
由此可见,与HSA相比,信号分子蛋白含量相差极大,血液蛋白含量跨越极大,可达1010,而含量极低的蛋白才是疾病的特异性生物标志物或者药物作用的靶标。
血液样本的特殊性在哪?血液中蛋白质的含量跨越极大,高丰度的白蛋白等掩盖了真正需要研究的低丰度蛋白,如IL-6等信号分子。信号分子等低丰度蛋白的价值及光芒急需被挖掘,被看见。那怎么才能被看见呢?
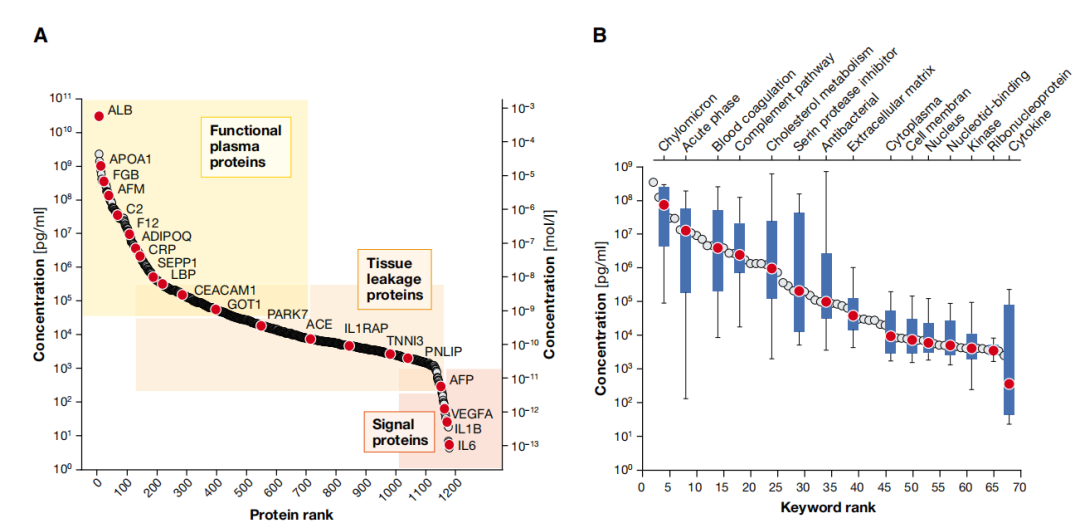
图1.血液蛋白构成及浓度范围
02. 低丰度蛋白:怎么能被看见?
由于血液蛋白质的特殊性,较宽的动态范围限制了质谱技术在血液中发现新的疾病标志物。
为了突破这一瓶颈,主要有2种应对策略:
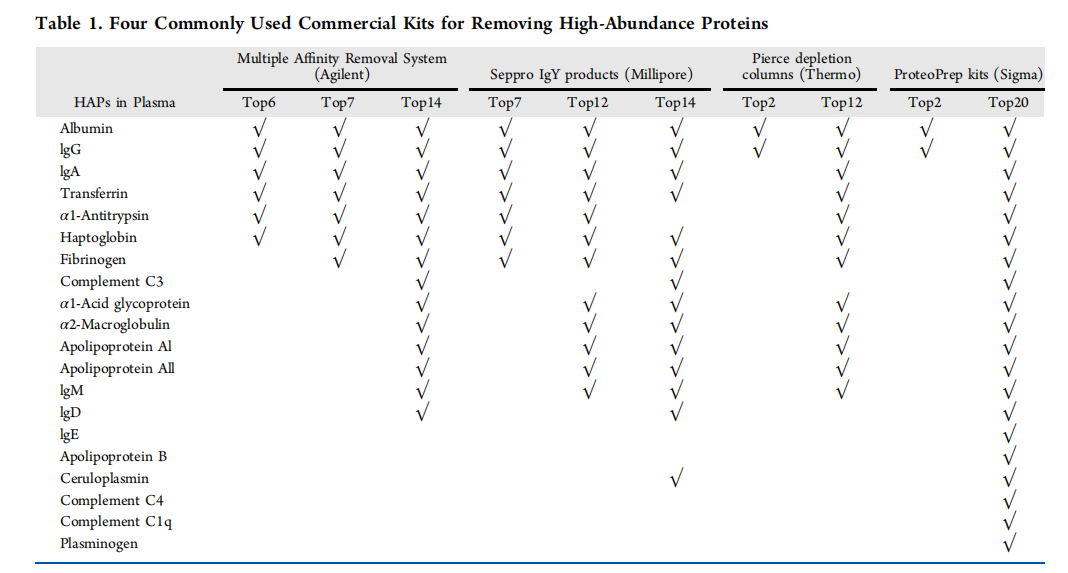
1)第一种:高丰度蛋白去除技术是一种常见的血浆样品前处理方法,通过去除白蛋白、球蛋白、免疫球蛋白等高丰度蛋白,有效提高样品中低丰度蛋白的浓度。目前,高丰度蛋白去除的主要方法有超滤法、电泳法、抗体亲和法等。
超滤法:以蛋白质的大小和结构为基础,在驱动力(通常由离心或压力条件产生)下将大分子高丰度蛋白分离出来,起到去除目的。该方法简单直接,成本低廉,没有物种限制,但对蛋白没有特异性,导致低丰度蛋白丢失严重,目前超滤法正在逐渐被淘汰。
电泳法:通过电泳将血浆蛋白分离成不同的条带,实现去除高丰度蛋白的目的。蛋白质在一维电泳里按照等电点分离,在第二维电泳里按照相对分子质量分离,与超滤法相比,电泳法能够更精准地分离目标蛋白。但二维凝胶电泳耗费时间长,分辨率和灵敏度不高,一次所需上样量大且操作复杂。
沉淀法:向血浆样品中添加可以引起蛋白质聚集和沉淀的试剂,如硫酸铵(AS)、二硫苏糖醇(DTT)等,通过离心去除沉淀蛋白,质谱分析上清液。其主要优势为操作简单,成本低廉,没有物种限制。尽管沉淀法操作简单且被广泛使用,但其低特异性和易导致低丰度蛋白丢失限制了它的大范围应用。近年来,几种改进或优化的沉淀方法被提出,包括两步差分蛋白质溶解度方法(使用多种浓度的AS来分馏和耗尽血浆样品中的高丰度蛋白)、串联去除法(结合硫酸铵沉淀和蛋白质亲和层析)等。
基于抗体的免疫亲和法:使用单克隆或多克隆抗体特异性去除血浆中的高丰度蛋白,从而纯化血浆样本。抗原与抗体结合具有良好的特异性和重复性,可用来去除那些在超滤法或电泳法中不能去除的高丰度蛋白。抗体亲和法已有很多商品化抗体亲和柱,如 Agilent、Millipore、Sigma-Aldrich、Thermo 等公司的抗体亲和柱。目前的抗体亲和柱已从最初的单抗发展到能同时去除 6 种、7 种、12 种、14种或 20 种的多亲和抗体柱。串联去除策略是去除更多高丰度蛋白的有效方法,如IgY4-SuperMix串联法可检测和定量血浆中的4,500种蛋白质。但基于抗体的免疫亲和法具有高成本、样品上样能力有限、超载时柱效下降等缺陷且固定化抗体可能无法识别高丰度蛋白的某些亚型。与此同时,高丰度蛋白的海绵效应也会导致去除高丰度蛋白的同时丢失部分低丰度蛋白,从而导致潜在的生物标志物丢失。
基于多肽的免疫亲和法(六肽配体亲和法):基于饱和-超载色谱原理,采用一个基于微球的高度多样化的大型组合肽配体库,可即时稀释高丰度蛋白和浓缩低丰度蛋白。每个蛋白与它们的肽结合伙伴之间具有特异性的相互作用。当样品进入试剂盒后,高丰度蛋白与它们所对应的配体迅速饱和,相反,丰度较低的蛋白质不会超载它们各自的配体,从而以浓度依赖的方式结合。高丰度蛋白质的部分消耗和低丰度的相对富集导致了整体蛋白质动态范围的压缩。然而,蛋白质和ProteoMiner肽库之间亲和力不同是该技术的主要局限之一。如果配体对特定蛋白质没有亲和性,或者亲和性很低,那么蛋白质就不会被捕获,从而无法被检测到。此外,pH等环境因素也可能影响其亲和力。
血液蛋白组的传统前处理策略是去除高丰度蛋白。但是有一些不常见的物种由于免疫结合的特异性无法适配市售的去高丰度试剂盒且在去除高丰度蛋白的同时会带走很多低丰度蛋白, 而丢失蛋白质信息。例如, 去除白蛋白的同时很可能会带走与白蛋白结合的细胞因子、肽类激素以及脂蛋白等低丰度蛋白。这种前处理方法有着明显的局限性。低丰度蛋白富集可以有效避免传统方法的缺陷,增加血浆蛋白组的检测深度和定量准确性。
2)第二种:富集低丰度,通过筛选不同理化性质得到的纳米颗粒,其主要原理是经特殊修饰的磁球接触血浆后,表面可吸附大量蛋白质形成蛋白冠。根据“Vroman效应”,更强结合亲和力的蛋白会和早期吸附的蛋白发生竞争性置换,从而对多种低丰度蛋白质进行富集,有效避免蛋白信息丢失。磁性纳米材料在低丰度蛋白富集领域备受瞩目,采用纳米颗粒特异性富集血液样本中低丰度蛋白,再结合新一代Orbitrap™ Astral™ 高分辨质谱仪平台,让血液蛋白鉴定深度和通量实现了质的飞跃。PuriMag BioTech依托自有知识产权的独特纳米磁珠制备技术和表面修饰技术,开发了一系列的针对不同蛋白亚群的低丰度蛋白富集试剂盒(http://www.purimagbead.com/Product/8096211554.html),实现了血浆和血清样本的蛋白高深度分析。
以下是血液中22种高丰度蛋白质的中英文名称、分子量(kDa)和等电点(pI)。请注意,这些数值是典型的或平均值,实际值可能因个体差异、蛋白质修饰和其他因素而有所不同。
1. **白蛋白 (Albumin)** - 分子量: 66-69 kDa, pI: 4.6-4.9
2. **α1-抗胰蛋白酶 (Alpha-1 Antitrypsin, AAT)** - 分子量: 52 kDa, pI: 5.0-5.3
3. **α1-酸性糖蛋白 (Alpha-1 Acid Glycoprotein, AAG or Orosomucoid)** - 分子量: 44 kDa, pI: 3.5-3.8
4. **α2-巨球蛋白 (Alpha-2 Macroglobulin, α2M)** - 分子量: 720-800 kDa, pI: 5.5-6.0
5. **C-反应蛋白 (C-Reactive Protein, CRP)** - 分子量: 115 kDa, pI: 5.7-6.1
6. **铜蓝蛋白 (Ceruloplasmin)** - 分子量: 132-150 kDa, pI: 5.5-6.0
7. **纤维蛋白原 (Fibrinogen)** - 分子量: 340 kDa, pI: 5.2-5.4
8. **免疫球蛋白G (Immunoglobulin G, IgG)** - 分子量: 150 kDa, pI: 6.5-7.5
9. **免疫球蛋白A (Immunoglobulin A, IgA)** - 分子量: 160 kDa (单体), pI: 6.5-7.5
10. **免疫球蛋白M (Immunoglobulin M, IgM)** - 分子量: 970 kDa (五聚体), pI: 5.0-7.0
11. **转铁蛋白 (Transferrin)** - 分子量: 79.5 kDa, pI: 5.5-6.2
12. **α1-抗糜蛋白酶 (Alpha-1 Antichymotrypsin, ACT)** - 分子量: 60 kDa, pI: 5.3-5.5
13. **α1-脂蛋白 (Alpha-1 Lipoprotein, LPAI)** - 分子量: 25 kDa, pI: 4.5-5.0
14. **α2-抗纤溶酶 (Alpha-2 Antiplasmin, AP)** - 分子量: 76 kDa, pI: 5.2-5.6
15. **β2-微球蛋白 (Beta-2 Microglobulin, B2M)** - 分子量: 11.8 kDa, pI: 5.0-5.3
16. **补体C3 (Complement C3, C3)** - 分子量: 184.6 kDa, pI: 5.5-6.0
17. **补体C4 (Complement C4, C4)** - 分子量: 197 kDa, pI: 5.0-5.5
18. **触珠蛋白 (Haptoglobin, HPX)** - 分子量: 85 kDa, pI: 5.3-6.3
19. **载脂蛋白A1 (Apolipoprotein A1, APOA1)** - 分子量: 28.3 kDa, pI: 5.5-6.0
20. **载脂蛋白A2 (Apolipoprotein A2, APOA2)** - 分子量: 17 kDa, pI: 5.0-5.4
21. **载脂蛋白B (Apolipoprotein B, APOB)** - 分子量: 512-550 kDa, pI: 5.0-5.5
22. **维生素D结合蛋白 (Vitamin D Binding Protein, Gc)** - 分子量: 52 kDa, pI: 5.0-5.5
- 上一篇:不同检测中心的纳米粒子表面蛋白冠检测差异性分析——重复性分析 2025/1/6
- 下一篇:HUPO发文总结2024年国际人类蛋白质组计划(HPP)研究 2024/12/16

