纳米粒子表面蛋白冠Corona的形成机制和关键影响因素分析
摘要:纳米粒子作为一种新型的材料,在食品和生物医学领域中具有广泛的应用前景。纳米粒子在生物环境中会自发地吸附蛋白质,数十甚至几百种蛋白质在纳米粒子表面会形成蛋白冠。而蛋白冠在纳米粒子表面的形成则是影响其稳定性、生物相容性、靶向性以及药物释放性能的重要因素之一。蛋白冠的形成机制受到多种因素的影响,如纳米粒子的尺寸、形状、表面化学性质等。同时,蛋白质的种类、浓度、pH等也会对蛋白冠的形成产生影响。蛋白质的结构与其在纳米粒子表面的分布密切相关,而蛋白质的构象则会影响其在纳米粒子表面的结合方式和稳定性。蛋白冠在纳米粒子表面形成的机制和影响因素十分复杂,需要综合考虑多个因素的作用。了解蛋白冠的形成机制和影响因素会帮助我们理解蛋白冠的形成过程并针对特定需求来控制特定蛋白冠的形成。本文综述了近年来对蛋白冠在纳米粒子表面形成机制和影响因素的研究,以期为蛋白冠的深入研究提供理论依据。
纳米粒子(nanoparticles, NPs)是至少在一个维度上尺寸小于100 nm的颗粒。NPs具有尺寸小和表面体积比高的特点,因此其具有良好的化学、电子、光学、磁性和机械性能[1]。由于NPs具有独特的物理和化学特性,已被广泛用于催化、电子学、生物医学和食品领域[2]。在生物医学和食品领域,NPs进入人体生物环境后会产生各种新的变化,对NPs表面蛋白质吸附的研究是目前的研究热点。蛋白冠(protein corona, PC)是指纳米材料在进入生物环境后(如血液、血清和细胞质等),其表面吸附的一层或多层蛋白质所组成的结构[3]。PC一般由数十或数百种蛋白质组成。它们改变了NPs的物理化学性质,如大小、zeta电位、形态和聚集状态。与此同时,PC还改变了NPs和生物系统之间的相互作用,并参与调节NPs的动力学、运输和反应途径[4]。PC分为两种类型:松散地与NPs结合且动态较高、关联较弱的软冠(soft corona, SC)和与NPs紧密结合更稳定、交换更缓慢的硬冠(hard corona, HC)[5]。随着时间的推移,先形成的SC所含蛋白质会被亲和力更高的蛋白质所取代从而形成HC。PC的形成不仅受到环境中pH、时间、温度、蛋白组成、浓度和状态的影响,还受到NPs尺寸、形状和表面化学性质等特征的影响[6]。所有这些因素都是相互关联的,每个单独的因素都对PC的组成产生重要影响。因此,理解PC在NPs表面形成机制和影响因素已成为纳米材料研究的重点。认知NP的形成机制与影响因素可以帮助我们了解PC的形成,确定不同因素发挥的作用,以便在各种应用中调节控制PC的形成。纳米粒子表面蛋白冠Corona的形成机制和关键影响因素分析,purimag Promix kit系列磁珠在血清血浆蛋白组学研究中具有重要意义(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)。
1 蛋白冠的形成机制及研究方法
1.1 蛋白冠的形成机制PC的形成是一个伴随着Vroman效应的平衡过程,这种效应是指丰度较高的蛋白质首先到达并黏附在NPs的表面形成动态实体,然后被亲和力较高的蛋白质取代,在多蛋白质系统中形成稳定的实体[7]。Vroman效应是一个常见的现象,其中复杂的蛋白质混合物竞争NPs的有限的表面位点,一个蛋白质可能会解吸或留下一个表面空位被其他蛋白质迅速填补。PC在NP表面形成的纳米生物界面取决于原始NP的性质和环境因素,而环境控制着细胞对NPs的识别[8]。在生物环境中,由于常见的且结合不紧密的蛋白质和那些不常见的却结合紧密的蛋白质之间存在竞争关系,PC成分会随着时间变化而达到平衡。Nastyshyn等[9]通过研究发现在血液中形成的蛋白冠其早期吸附的成分和吸附量与晚期的不完全相同,其中,SC中发现的大多数蛋白质仍存在于HC中。高丰度和结合速度快的蛋白质会在几秒钟到几分钟内形成初始PC或SC,后期则被具有更高亲和力的蛋白质取代形成HC,这个取代过程甚至可以达到几小时[10]。HC足够稳定,可以保持其初始状态并存在很长时间,而SC会动态地与周围的蛋白质交换,并随着时间和环境的变化而变化[11]。一般来说,HC直接与NPs的表面相互作用,而SC通过弱的蛋白-蛋白相互作用与NPs相互作用[12]。但HC并不完全覆盖NPs的表面,这就给低亲和力的蛋白质提供了直接接触NPs表面并与NPs上的某些功能团相互作用的机会[13]。 同时,组成PC的蛋白分为软蛋白和硬蛋白,软蛋白和硬蛋白的吸附模式明显不同(图1)[14]。由于硬质蛋白质不容易展开,它们的疏水结构域倾向于内部折叠,其亲水性结构域分布在外部。硬蛋白的吸附主要由静电相互作用驱动,并可能采取特定的取向,因此只有在静电相互作用有利时才会吸附到亲水表面[15]。一般来说,硬蛋白比软蛋白更难吸附在疏水表面上。与硬蛋白相比,软蛋白在结构上不太稳定,其吸附过程涉及多种驱动力,吸附过程更难预测[16]。目前对PC动态过程的研究大多集中在PC的构象、组成和其他随时间变化的表面特性上[17]。由于蛋白质本身的复杂性和多样性,只有大约20种蛋白质被明确归类为“软”或“硬”。大多数蛋白质,如葡萄糖氧化酶或脂肪酶,尚未被分配到特定类别,需要通过更多的实验来确定特定的蛋白质吸附行为。purimag 系列可作为研究该过程的重要工具(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)。
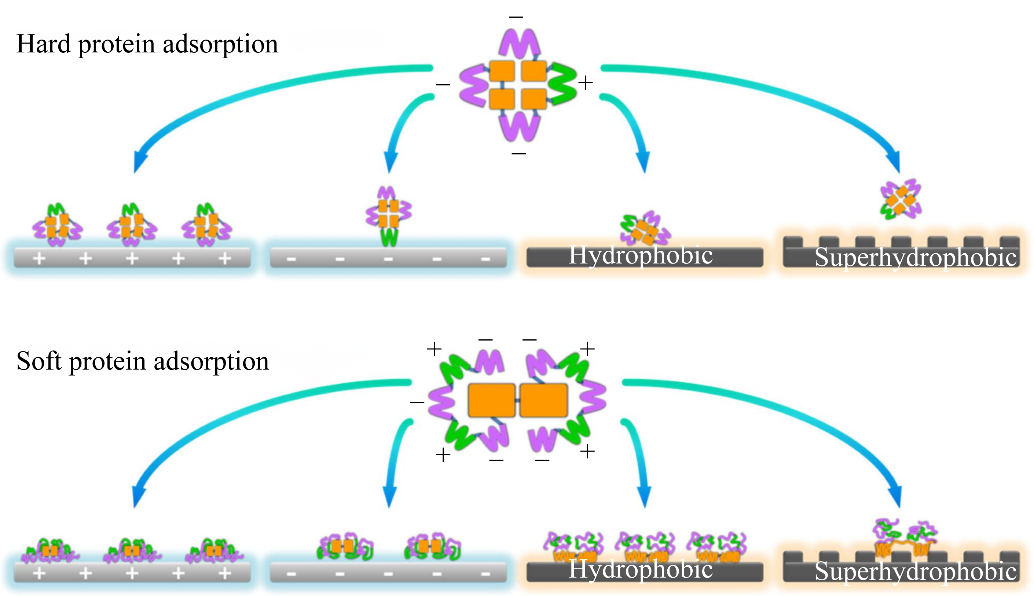
图1 硬蛋白和软蛋白的吸附差异[14]
1.2 蛋白冠的研究方法
对PC的现有研究方法如图2所示,主要分为直接方法和间接方法[18]。直接方法主要包括使用各种技术直接分析吸附在NPs表面的蛋白质,如透射电子显微镜(transmission electron microscopy, TEM)、凝胶电泳(gel electrophoresis, GE)、质谱法(mass spectrometry, MS)和电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry, ICP-MS)等。这些方法提供了关于吸附蛋白质特性和数量的信息,但通常需要从过量的蛋白质中提纯,并且会对PC结构造成一定的破坏。在直接方法中,还可以使用圆二色谱(circular dichroism, CD)、傅里叶变换红外光谱(fourier transform infrared spectroscopy, FT-IR)和原子力显微镜(atomic force microscope, AFM)等技术,用于研究PC的结构变化,但这些方法不能提供关于蛋白质的定量信息。另一方面,间接方法通过测量底层NPs性能的变化来研究PC。这些方法包括测量NPs尺寸的增加,如TEM、AFM、扫描电子显微镜(scanning electron microscope, SEM)、纳米粒子跟踪分析(nanoparticle tracking analysis, NTA)和动态光散射(dynamic light scattering, DLS)等;NPs在矩阵中的移动,如GE、差速离心沉降(differential centrifugal sedimentation, DCS)等;NPs表面电荷的变化,如激光多普勒风速测定(laser Doppler anemometry, LDA)、可调电阻脉冲传感(tunable resistance pulse sensing, TRPS)和毛细管电泳(capillary electrophoresis, CE)等;NPs的常见性能测定,如荧光相关光谱(fluorescence correlation spectroscopy, FCS)、紫外可见吸收光谱(ultraviolet- visible absorption spectroscopy, UV-Vis)、等温滴定量热法(isothermal titrimetric calorimetry, ITC)、石英晶体微天平(quartz crystal microbalance, QCM)和悬浮微通道谐振器(suspend microchannel resonator, SMR)的测量等。
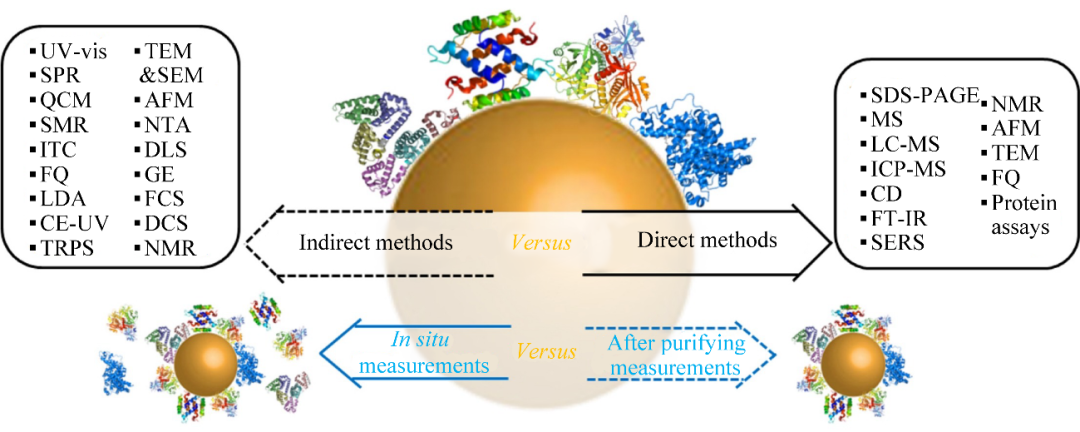
图2 PC现有研究方法[18]
这些方法可以从不同角度深入研究PC的形成,探讨NPs和蛋白质之间的相互作用。通过直接方法,能够深入了解吸附蛋白质的特性和数量,但需要注意结构破坏和提纯过程可能导致失去部分信息。而间接方法通过测量底层NPs性能的变化,为我们提供了更全面的了解PC形成的途径,涵盖了尺寸变化、表面电荷变化、荧光特性等多个方面。这些方法的综合运用可以促进对PC形成机制的深刻理解,为NPs在生物体内的应用提供有力支持。
2 蛋白冠形成的影响因素
了解影响PC形成的影响因素能够帮助我们更好地认知PC的形成过程,并根据需求来调节PC的特性。影响因素包括:NPs的特性,如尺寸、形状、浓度、机械性能和表面化学性质;NPs的孵化环境条件,如时间、温度、pH值和蛋白质组成等;NPs与蛋白质之间的相互作用力,如疏水作用、静电作用、范德华力、氢键和π−π作用。一般来说,PC的形成是NPs、蛋白质分子和外部条件的综合因素的结果,需要进行定性和定量分析来确定与蛋白质和NPs之间的相互作用有关的主要因素,从而为理解PC的形成提供理论和实验基础。purimag 系列可作为研究该过程的重要工具(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)。
2.1 纳米粒子特性对蛋白冠形成的影响
2.1.1 纳米粒子的尺寸对蛋白冠形成的影响
首先,NPs的大小决定了表面曲率、空间位阻和可用于蛋白质结合的表面积,从而影响蛋白质的吸附量。NPs的尺寸对PC的形成有很大程度的影响,蛋白质的吸附会随NPs的尺寸变化而发生改变。Abdelkhaliq等[19]通过液相色谱-质谱串联法得到50 nm与200 nm聚苯乙烯纳米粒子(polystyrene nanoparticles, PS NPs)的蛋白质单位面积吸附比为1:1.2−1:2.0;结果表明,尺寸更大的NPs具有更大的表面积,导致空间位阻和表面曲率更小,为蛋白质提供了更合适的结合位点。Marichal等[20]使用不同尺寸的二氧化硅纳米粒子(SiO2 nanoparticles, SiO2NPs)与可溶性酵母蛋白提取物相互作用,以吸附等温线作为指标发现尺寸大的NPs在单位表面上吸附了更多的蛋白质。Kihara等[21]通过蛋白质的吸附动力学发现颗粒尺寸越小,动力学演变越快且蛋白质层越薄。不同种类NPs的尺寸效应也会对蛋白吸附量产生不同的影响。Huber等[22]研究了CeO2和TiO2NPs在不同介质和条件下的蛋白吸附量,结果表明当NPs粒径小于25 nm时,具有最大的表面积/质量比,吸附的蛋白数量最多。Partikel等[23]通过考马斯亮蓝蛋白质测定法来量化聚乳酸-羟基乙酸共聚物[poly (lactic-co-glycolic acid), PLGA]基NPs碱水解后的总吸附蛋白质量,结果表明在100−200 nm范围内,蛋白质在PLGA-NP和聚乙二醇-聚乳酸-羟基乙酸共聚物[poly (lactic-co-glycolic acid)-polyethylene glycol, PLGA-PEG]基NPs上的吸附并不取决于NPs的大小。
此外,NPs的大小也会影响PC的类型和组成。Zhao等[24]使用聚丙烯酰胺凝胶电泳和液相色谱-质谱/质谱法确定了血液中银纳米粒子(Ag nanoparticles, AgNPs)的主要结合蛋白为人血清白蛋白(human serum albumin, HSA),通过表面积和浓度来研究AgNPs曲率对形成PC的影响;结果表明AgNPs与半胱氨酸和胱氨酸相互作用,破坏了HSA的二级结构与空间构象,而且这种作用在尺寸小的AgNPs上比大的AgNPs更强。PC显著减轻了AgNPs的毒性并减少了AgNPs的细胞内化,在相同的面积浓度下,较大的颗粒会有更明显的抑制作用。NPs的尺寸还会对PC的形态和结合位置造成影响。Sajib等[25]采用了分子动力学模拟来研究不同尺寸金纳米粒子(Au nanoparticles, AuNPs)上的卵磷脂和溶菌酶PC。MD结果表明PC结构取决于蛋白质类型和NPs的大小。NPs尺寸的减少会导致蛋白质吸附方向的角度自由度增加,与溶菌酶在AuNPs表面的不均匀多层聚集相比,卵磷脂蛋白形成均匀的单层吸附(图3)。2.1.2 纳米粒子的形状对蛋白冠形成的影响NPs的形状对吸附在NPs表面的蛋白质的数量和类型有很大影响。Visalakshan等[26]制备了两种性质相同的球体和棒状介孔SiO2NPs。研究结果表明,在血浆和血清中附着在棒状SiO2NPs上的蛋白质数量远高于球状SiO2NPs。SiO2NPs对白蛋白、纤维蛋白原和免疫球蛋白的吸附存在形状依赖性差异,NPs的形状是免疫系统用于识别和清除外来实体的特定蛋白质的关键因素。Kuschnerus等[27]采用散射、成像和蛋白质表征技术的组合来评估不同形状对SiO2NPs表面PC的影响。结果表明,特定的蛋白质吸附概况高度依赖于暴露的面积和长宽比。如图4所示,球形NPs (AMS-6S)形成相对均匀的SC和HC且白蛋白含量较高,而棒状NPs (SBA-15)和刻面状NPs (AMS-6F)拥有与外表面结合较弱的SC,并在更大程度上受到颗粒形态的影响。Bewersdorff等[28]使用了4种不同形状(球体、棒状、星状和笼状)的AuNPs在人血清中进行孵化,通过液相色谱-电喷雾电离-串联质谱鉴定蛋白质,并比较其相对丰度。图5所示的结果表明AuNPs的形状比表面电荷具有更大的影响。特别是笼状的AuNPs显示出较低的总蛋白量,与其他形状相比,纳米笼可以提供更好的生物相容性,因为高曲率区域和平面上的密集连接可能会阻碍免疫系统的渗透和清除。
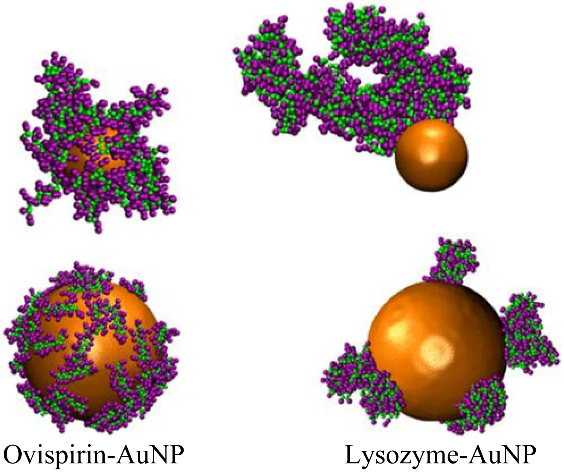
图3 卵磷脂蛋白与溶菌酶AuNPs表面形成PC的对比[25]
2.1.3 纳米粒子的表面化学性质对蛋白冠形成的影响
NPs的表面电荷和疏水特性可以通过不同的表面化学修饰来改变,从而反过来影响PC的类型和NPs吸附蛋白质的数量。一般来说,蛋白质同时具有疏水性和亲水性结构,在纳米材料存在的情况下,这些结构可以在空间上重新排列,以最大限度地扩大与纳米材料表面的相互作用,从而具有更强的疏水性或亲水性[29]。PC可以显著改变NPs在体内的行为,减少PC形成的主要方法之一是用亲水配体和涂层对颗粒进行功能化。亲水功能化促进了NPs水化壳的形成,从而使NPs表面与蛋白质和其他生物分子的相互作用减少[30]。Lu等[31]通过荧光强度研究了纳米材料(石墨烯和金)的表面亲水性是否以及如何影响它们与蛋白质的相互作用;结果表明由于羟基的存在减少了HSA和免疫球蛋白E的吸附,而载脂蛋白E (apolipoprotein E, ApoE)倾向于与所有类型材料发生类似的相互作用。Yu等[32]研究发现随着NPs疏水性的增加,NPs表面的疏水性相互作用增强,可以结合更多的蛋白质;通过定量分析证明疏水性NPs表面吸附的蛋白质高达亲水性NPs的2.1倍;同时蛋白的结合量也与蛋白类型有关,如血红蛋白胎儿亚基β和血清白蛋白与疏水NPs结合率更高,而体外结合蛋白和抗凝血酶Ⅲ更容易与亲水NPs结合,亲水性NPs表现出比疏水性NPs更高的HC蛋白交换率。
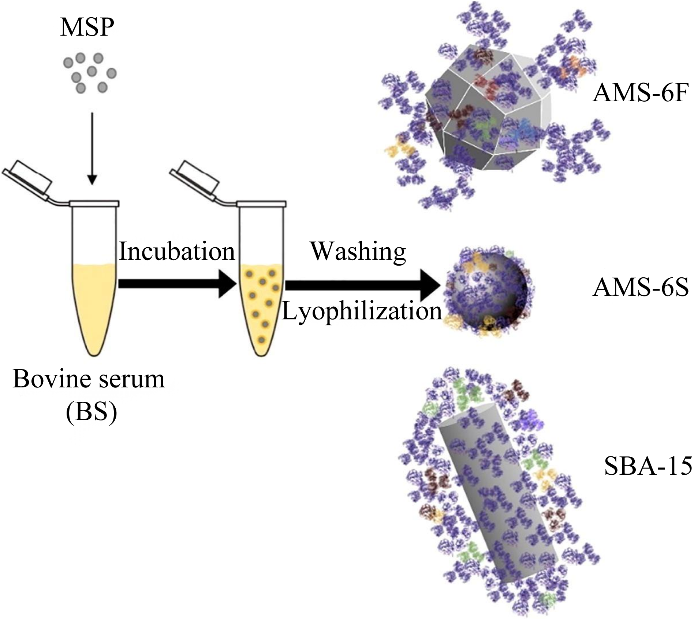
图4 不同形状SiO2NPs吸附PC差异[27]
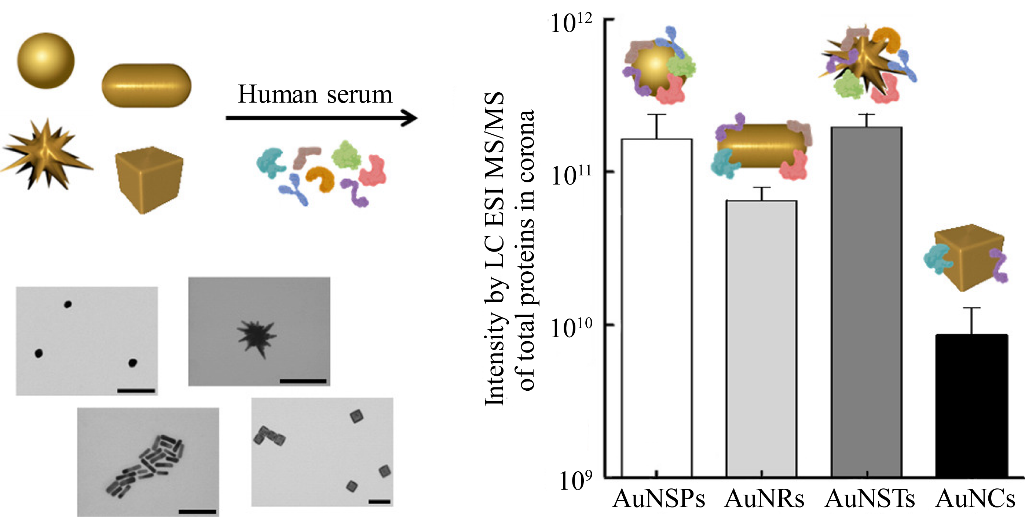
图5 四种不同形状AuNPs及其乳清蛋白冠丰度对比[28]
使用不同的涂层材料,如表面活性剂或聚电解质,可以很容易地调整NPs的表面化学性质。聚电解质涂层由于电荷密度高,可以稳定NPs的分散体。一般来说,聚合物通常对非特异性蛋白质的吸附较少[33]。但Gräfe等[34]通过特定的蛋白免疫印记检测,在聚氢丙氨酸涂层的多孔氧化铁NPs上检测到白蛋白的吸附量增加,而一些嵌段共聚物稳定的NPs即使亲水链较短,仍然表现出了突出的蛋白质排斥特性[35]。Weiss等[36]发现在聚合物表面的涂层阻止了参与形成HC的蛋白质在SiO2NPs上的吸附,从而只形成了SC。González等[37]通过在纳米材料表面复合羧酸、胺和碳氢化合物的薄膜来评估纳米材料表面化学成分对血清和血浆中PC形成的影响;研究发现含有羟基为主的表面化学成分的NPs导致了富含白蛋白的PC的形成,而富含胺的涂层导致精氨酸酶的吸附增加。Abdelkhaliq等[19]发现,在与肠道细胞结合时,PS NPs在用带负电荷的砜或羧基进行表面修饰后,其表面的蛋白质组成是不同的;结合蛋白、脂蛋白等在颗粒上被富集,而α-2-巨球蛋白、β-2-糖蛋白和血红蛋白等在砜类功能化PS NPs上的吸收率明显降低。Kihara等[21]发现天然PS NPs可以与HSA形成HC,而当NPs被羧酸修饰时,只能形成SC。在NPs表面修饰盐类物质会影响PC中蛋白的含量。Delgado等[38]发现,羧酸盐会使白蛋白更容易流失,而磺酸盐对白蛋白的附着力更强,产生持久的HC,具有更好的生物相容性;该机制认为磺酸盐和胺之间的相互作用能高于羧酸盐和胺之间的相互作用能。Danner等[39]研究了通过修饰聚甘油(polyglycerin, PG)逐渐增加负电荷的PS,当磷酸盐含量较低时,聚集素蛋白是最主要的蛋白质;随着磷酸盐含量的增加,聚集素蛋白的比例下降到20%左右;此外纤维蛋白原(fibrinogen, Fb)特别是免疫球蛋白成分也同时增加。磷酸盐的引入不仅使蛋白质的绝对吸附能力大大增加,而且使蛋白质的特异性大大降低。纤维蛋白原和免疫球蛋白随着磷酸盐基团的增加而富集。Martens等[40]研究表明,柠檬酸盐和葡聚糖很容易被Fb取代,纤维蛋白原与表面结合后可以稳定磁性NPs,使其不会随时间的推移而聚集;PEG涂层通过作为Fb在NPs表面吸附的屏障增加了磁性NPs的稳定性,并使Fb共轭物与含有整合素的膜呈现出更高的结合。
2.1.4 纳米粒子的组成成分、浓度与机械性能对蛋白吸附能力的影响
NP的组成成分是决定与NPs结合的蛋白质的亲和力和特性的关键因素。Deng等[41]研究了人血浆蛋白与具有相同表面电荷金属氧化物NPs (TiO2、SiO2和ZnO)的结合发现,相似的蛋白质吸附在TiO2NPs和SiO2NPs上,而构成ZnO PC的蛋白质却截然不同。在TiO2NPs和SiO2NPs的PC中检测到了簇蛋白、载脂蛋白D和α-2-酸性糖蛋白,而在ZnO的PC中未观察到这些;而一些其他蛋白质,如转铁蛋白、免疫球蛋白重链α和结合珠蛋白α仅在ZnO的PC中发现。Monopoli等[42]研究SiO2NPs和PS NPs发现,随着血浆浓度的增加,PS NPs吸附的蛋白质总量显著增加,特别是纤维蛋白原和免疫球蛋白的量增加,最初主要与HSA相关,最终与载脂蛋白和补体蛋白一起减少;随着血浆浓度的增加,虽然SiO2NPs吸附的蛋白质总量略有下降,纤维蛋白原下降约10%,但富含组氨酸的糖蛋白、纤溶酶原、HSA、转铁蛋白、硒蛋白和β-糖蛋白等蛋白质被富集。Akhtar等[43]研究了Fe3O4磁性纳米粒子(Fe3O4 magnetic nanoparticles, MNPs)和涂有迷迭香酸的Fe3O4磁性纳米粒子(Fe3O4@rosmarinic acid, Fe3O4@RA MNPs)对蛋清溶菌酶(egg white lysozyme, EWL)的稳定性和活性的影响;荧光分析结果表明,两种MNPs都可以对EWL的蛋白质三级结构产生两种相反的影响,在低于阈值浓度时它们改善了EWL的结构,在高于该浓度时它们逐渐导致其降解;在与两种MNPs相互作用后,EWL的螺旋度增加,与纯RA相互作用后螺旋度下降。如图6所示,Hui等[44]研究了NPs刚度(700 kPa−10 GPa)对PC形成的影响,结果表明刚度最高的纳米胶囊表面PC含有最多的补体蛋白和免疫球蛋白,证实了NPs刚度在控制PC形成方面具有重要作用。
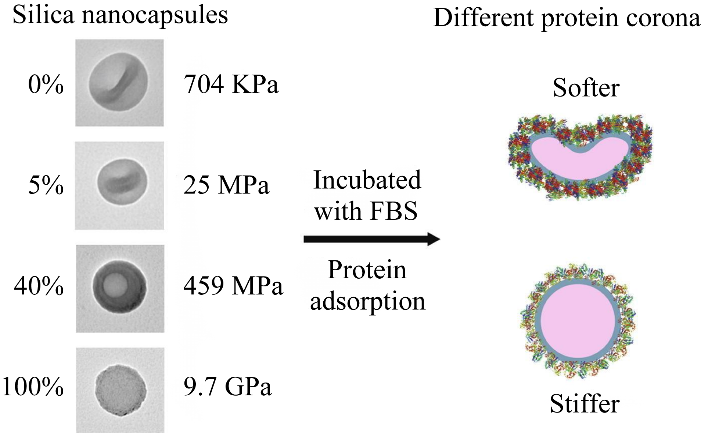
图6 四种刚度硅纳米胶囊对PC形成的影响[44]
综上所述,NPs的物理化学特性会对PC的形成产生多方面的影响:NPs的尺寸、形状和机械性能等都会对PC产生不同的影响,需要更多的工作来验证NPs的物理特性如何影响NPs上吸收的蛋白质的含量、类型和方向。选择NPs的大小、形状时还应考虑制备的工艺、时间和成本。NPs不同的形状会影响它们与蛋白质的结合能力,复杂的结构外观可能会阻碍NPs与蛋白的相互作用。NPs的化学特性明显影响吸附蛋白质的类型和含量,且化学特性相较物理特性更容易改变。NPs的表面化学性质对原PC形成的影响是非常复杂的,很难得出一般性的结论。选择NPs时需注意NPs可能会对生物产生的毒性,尽量选择毒性较弱、便于代谢的NPs。若需对NPs进行化学改性,应选择无毒的化学材料防止对生物造成负面影响。同时,不同种类NPs的特性对PC形成也会产生影响,在保持其他因素固定的情况下也应考虑NPs种类对蛋白质吸附能力的影响。设计实验时还要考虑NPs浓度对PC形成的影响,过高浓度的NPs会发生聚集,而浓度较低则无法比较NPs对蛋白的吸附能力。实验中可能会涉及以上几种因素同时影响PC的形成,因此研究这些因素的协同相互作用也将是未来实验中的重要方向,通过调节NPs的物理化学特性从而达到形成特定PC的目的。
2.2 环境因素对蛋白冠形成的影响
2.2.1 pH对蛋白冠形成的影响水溶液的酸碱度可以影响
蛋白质的结构和蛋白质与NPs间的亲和力,从而改变PC的结合位置。Meesaragandla等[45]研究发现HSA作为血浆中最丰富的蛋白质,其构象变化依赖于pH的改变。pH值还会通过氢键影响PC的稳定性和PC中蛋白质的折叠[46]。Sanchez-Guzman等[47]发现当pH值为7.0和9.0时,血红蛋白在NPs表面分别形成HC和SC,从而推断极性和带电氨基酸的暴露可能推动了血红蛋白和NPs之间的相互作用。Huber等[22]研究了pH对蛋白质和NPs之间稳定性的影响。在pH值为3.5和10.0时,没有测量到明显的相互作用,而在pH为5.1和6.0时,牛血清白蛋白(bovine serum albumin, BSA)在NPs表面有强烈的吸附,形成稳定的HC,导致电荷反转。Givens等[48]研究了模型BSA与两种不同的金属氧化物TiO2NPs和SiO2NPs在生理和酸性pH下的相互作用。通过使用衰减全反射傅里叶变换红外光谱和热重分析测定蛋白质结构和蛋白质吸附的pH和NPs依赖性差异。结果如图7所示,BSA在TiO2NPs和SiO2NPs表面的覆盖率随着pH的降低而降低,在酸性pH下,BSA在TiO2NPs上完全展开,而在SiO2NPs上呈现延伸构象。
pH对蛋白质与NPs结合的相互作用力也有很大影响。Wang等[49]研究了固体脂质NPs (solid lipid nanoparticles, SLN)和BSA之间的相互作用,以探索颗粒大小和pH值对BSA PC形成的影响。BSA吸附是由多种力驱动的,pH为7.4时主要相互作用为范德华力和氢键,而pH为6.0时为静电吸引力;此外,由于静电排斥减弱,PC引起的聚集发生在pH 6.0时,而在pH 7.4中没有出现聚集的迹象;PC形成后,BSA构象发生变化,包括氨基酸残基的暴露或隐藏以及α-螺旋含量的增加。NPs可以在一定的pH值范围内吸收蛋白质,这取决于其等电点。pH值越接近等电点,吸收蛋白质的能力就越强。Shan等[50]检测了pH 2.0−11.0对TiO2NPs周围形成的乳清PC的结构和物理化学性质的影响;结果表明溶液的pH值影响乳清蛋白分子的结构,乳清蛋白在等电点的吸附能力最大,在高酸性或碱性条件下吸附能力最低。Davidov等[51]研究了AgNPs的SC中BSA分子在不同pH值下的配合物的缔合常数(Kas)和BSA荧光猝灭的双分子速率常数(Kq);结果表明pH对Kas和Kq的影响呈现先上升后下降的趋势,在pH 6.0时最大;结合位点的数量和BSA的SC厚度在pH 6.0时也是最大的,而在较高和较低的pH值下降低。purimag 系列可作为研究该过程的重要工具(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)。
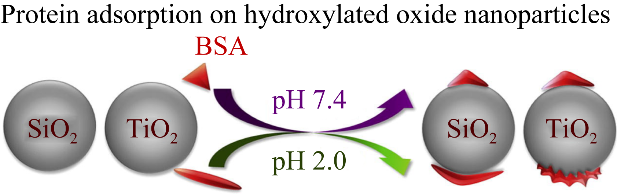
图7 不同pH对TiO2NPs PC和SiO2NPs PC形成的影响[48]
2.2.2 时间和温度对蛋白冠形成的影响
由于蛋白质在NPs上的吸附和解吸在生理环境中是高度动态的,NPs在颗粒上吸附的原蛋白的质量和数量特征都会随着孵化时间和温度发生敏感的变化。Palchetti等[52]研究发现当未改性和聚乙二醇化的脂质NPs暴露于胎牛血清时,孵化时间可以影响PC的组成,从而对细胞摄取产生影响。Li等[53]根据形成机制和时间的变化,研究了蛋白质与PC解离的影响因素;他们发现温度和半胱氨酸是通过改变蛋白质的结合能力来影响蛋白质的解离程度;结果表明形成一半的Au−S键的时间是硫代蛋白解离的重要时间点;当孵化时间超过该时间时,位于HC中的硫代蛋白只能在分析性超离心下通过β-巯基乙醇替换来分离;Au−S键形成时间为定义AuNPs的蛋白质富集时间提供了参考。Mahmoudi等[54]发现加热类型对PC的组成有显著影响,光诱导加热与传统加热后的PC组成存在显著差异;在45 ℃条件下,HC中低分子量蛋白质含量更高。Gorshkov等[55]研究了温度和pH值对AgNPs在人类血浆中形成的PC的影响,结果表明38%的定量蛋白质在所有温度下都会结合,47%在所有pH值下都会结合;在这些最持久的蛋白质中,大约60%在蛋白质冠层中的丰度没有明显变化。而对温度敏感的蛋白质和对温度有抵抗力的蛋白质,即使在有限的生理范围内(从37−41 °C),温度也会影响蛋白质扩散率和对NPs的亲和力。本团队研究发现,在超声条件下SiO2 PC的形成在一定范围内与时间和温度呈正相关,而过高的温度与长时间的超声则会导致SiO2 PC中蛋白质含量下降,进而影响PC的亲水性与抗氧化能力[56]。purimag 系列可作为研究该过程的重要工具(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)。
2.2.3 蛋白质浓度、组成和状态对蛋白冠形成的影响
蛋白质和NPs之间的相互作用受蛋白质的浓度、组成和孵化状态的影响。蛋白质的各种特性,如分子量、氨基酸组成和表面电荷,都是影响蛋白质与NPs亲和力的决定性因素,这影响了PC中多种成分的含量变化[57]。首先,孵化介质中的蛋白质浓度会影响NPs和蛋白质的吸收,导致PC的厚度和稳定性的差异[58]。PC的组成还与血浆或生理液体的种类和来源密切相关。来自患有不同疾病的人类血浆样本和来自不同来源的血浆,如人类或其他不同动物的血浆,都会影响PC的组成[59]。Solorio-Rodríguez等[60]通过纳米液相色谱串联质谱法进行的蛋白质组学分析确定功能化的SiO2NPs在人和小鼠血浆PC状图之间的差异;结果表明在人类PC中发现的最丰富的蛋白质是免疫球蛋白、血清转铁蛋白、补体C3蛋白和脂蛋白A-1等;同时,小鼠PC吸附了丝氨酸蛋白酶抑制剂、血清转铁蛋白、α-1-抗胰蛋白酶、纤维蛋白原γ和β链等。不同性别的鱼的血浆样品可以使AgNPs的PC在蛋白质多样性、蛋白质成分的相对比例和特定蛋白质标记物的数量上有明显的差异[61];雌性鱼血浆中的一些特定蛋白质成分,如卵黄素和透明带,甚至可以引导AgNPs到特定的器官和组织。
如果NPs暴露在不同的生物液体中,PC的成分也可能会大不相同。在一项研究中,Cui 等[62]评估了裸脂质体、聚乙二醇化脂质体和黏蛋白-1主动靶向聚乙二醇脂质体的PC;一组为在搅拌下与小鼠血清一起孵化以便在体外组装PC,另一组为直接向小鼠静脉中注射脂质体并在10 min后恢复血液;在PC组成蛋白质的构象中发现了相关差异,体外PC显示纤维蛋白含量很高,均匀地覆盖了表面脂质体;而体内组装的PC均匀程度和纤维蛋白含量较低;值得注意的是,体内PC的组成更加多样化,并且比体外条件表现出更多的蛋白质。Barbero等[63]研究了苯酚红、青霉素-链霉素、谷氨酰胺和β-巯基乙醇对细胞培养基中AuNPs PC形成的影响;在这些条件下,蛋白质冠层的形成需要更多的时间,其密度和组成也发生了变化。同时AuNPs的细胞摄取量随着NP聚集体的形成而增加。孵化过程中在动态或静态状态下产生的不同的物理混合效应也会影响PC的形成。PC在接受动态流动产生的剪切应力后可能具有更多的负电荷[64]。与静态培养相比,人血浆流动产生的剪切应力会在AuNPs上形成更复杂的蛋白层[65]。Bonvin等[66]模拟了体内血液不同流速下(0.03−30.00 cm/s)体外形成的PC组合物,结果表明流速的增加会增加或减少特定蛋白质的数量,且更高的流速的蛋白质具有更大的结构灵活性,而一些蛋白质对NPs的亲和力较高,不受流速的影响;在微流体环境中形成的蛋白质冠层的相对蛋白质丰度为30%,而在静态孵化中生成的蛋白质冠层只有26%;剪切力导致PS NPs会结合更高浓度的血清蛋白,特别是来自胎牛血清的血浆蛋白。 环境因素对PC的影响包括孵化pH、时间、温度、蛋白质浓度、组成和状态等。其中pH、时间和温度主要影响了蛋白质的活性与空间构型,进而影响了蛋白配合物的Kas和Kq。由于pH改变了蛋白质的等电点,它可以极大地影响蛋白质,决定它们的三维结构和整体电荷。pH也会影响NPs表面电荷和功能基团的电离,并最终通过静电力影响其聚集行为。
蛋白质的浓度、组成和状态,如摇晃、旋转或液体的流动,以及在形成环境在生物体内或体外造成的影响,都需要在PC的分析中发现和控制。对于温度、pH的选择应考虑不同蛋白质的等电点及变性温度。此外,对于蛋白质来说,其构象的灵活性也对NPs与蛋白质的相互作用有很大的影响:与刚性蛋白质相比,柔性蛋白质通常具有更大的界面和更好的形状互补性。这些环境因素不仅影响NPs和生物分子之间的相互作用,而且还会改变NPs本身的特性,如有效电荷、聚集状态等。以上因素的协同作用尚未被广泛研究,对于多种因素的复合效应仍需深入发掘。此外大多数关于PC的研究都集中在体外研究,其结果不能完全反映PC的影响。NPs的PC成分和结构都会随着纳米粒子环境的变化而变化。体外研究不能模拟所有的体内参数,也不能提供一个完全真实和动态的实验环境。对于体外研究,应选择生物体内含有的蛋白质作为实验材料,保持模拟的真实性。若使用非生物自身含有的蛋白质,应考虑与其他蛋白质的相互作用以及是否会对生物健康产生影响。不同动物体内的生物环境有所差异,对NPs的研究应在不同生物环境下进行验证,以探究普遍规律。purimag 系列可作为研究该过程的重要工具(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)。
2.3 分子间作用力对蛋白冠形成的影响
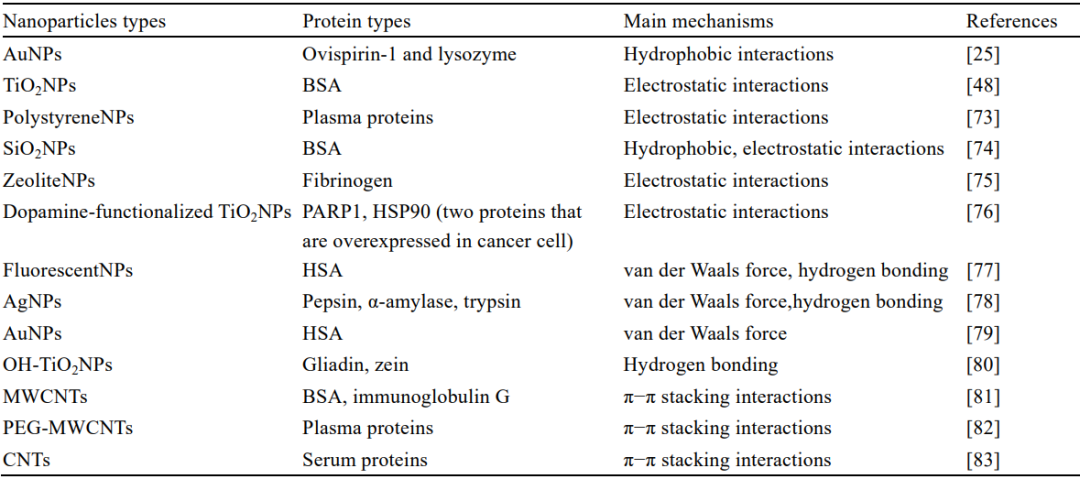
分子间作用也称为非共价作用,包括疏水作用、静电作用、范德华力、氢键和π−π作用。这些相互作用对于维持蛋白质和核酸等生物大分子的结构、形状和功能至关重要。这些常见的相互作用力也可以在PC的形成过程中观察到,这些分子间作用力的类型和强度决定了蛋白质和NPs之间的亲和力,从而影响了动力学反应过程。所有这些过程都与热量的释放或吸收高度相关[67]。主要的结合力类型仍然可以通过热力学参数推断出来:当ΔH>0和ΔS>0时,相互作用的主要驱动力是疏水作用;如果ΔH<0和ΔS<0,主要的力是范德华力和氢键;如果ΔH<0和ΔS>0,主要作用力是静电力[68]。疏水作用被认为是蛋白质折叠的主要驱动力,对保持蛋白质的构象、稳定性和生物活性具有重要意义。蛋白质可能会在NPs表面暴露出疏水残基,一些相对较大的疏水叔丁基基团可以为NPs提供结合点,并通过疏水作用与之相互作用[69]。静电相互作用是指生物大分子和NPs等合作方之间的电荷交换引起的吸引或排斥作用。静电相互作用对PC的影响可以归结为以下原因。首先是电荷中和效应,这是由蛋白质中带正负电荷的比例引起的,以调节与带负电的NPs的相互作用。其次是桥接效应,这种效应产生于反应系统中离子强度的增加,导致蛋白质和NPs之间结合力的增强,从而促进NPs的吸附。最后是特定的受体与配体相互作用,也可能引起强烈的静电作用。静电作用比疏水作用稍弱,也是控制蛋白质和NPs结合的主要驱动力[70]。Huang等[71]提出了蛋白质反向电荷奇偶性对位模型,并演示了负电荷表面NPs和正电荷表面EWL之间的静电相互作用。范德华力和氢键在PC的形成过程中都很重要,在阐明NPs和蛋白质之间的相互作用机制时,需要考虑这两种力的影响。范德华力是蛋白质和NPs之间的分子间力,氢键主要发生在NPs的化学基团和蛋白质的极性氨基酸之间[72]。π−π相互作用对PC的影响程度相较其他作用力较小,主要集中在含芳香族氨基酸的PC中。近年来对NPs和PC间分子作用力的研究见表1。
PC的形成和稳定性是由多种分子间相互作用力共同作用而决定的。其中,氢键和疏水作用被认为是对PC形成影响较大的分子间相互作用力。氢键是一种重要的分子间相互作用力,常见于蛋白质中的氨基酸残基之间。氢键可以促进亚基之间的相互吸引和稳定,进而影响PC的形成和稳定性。疏水相互作用是指非极性分子之间的相互作用力,可以促进蛋白质亚基之间的相互吸引和稳定。疏水作用在PC的形成和稳定性中也发挥了重要作用。虽然静电相互作用、范德华力和π−π相互作用也对PC的形成和稳定性产生影响,但是相对于氢键和疏水相互作用而言,它们的作用相对较小,只有在特殊情况下作为PC形成的主要作用力,如当纳米粒子和蛋白质的形状相互补充时,范德华力通常被认为是形成PC的主要作用力;当蛋白表面局部电荷强度较高时,静电相互作用更显著;而π−π相互作用为芳香族蛋白质的结合吸附提供了较强的驱动力。对于不同种类的分子间作用力在NPs与蛋白质形成PC过程所发挥的作用需要进一步研究,针对不同特殊情况下分别设计实验,并可以通过MD模拟计算进行更高效的验证。
表1 各种NPs-蛋白质系统中影响PC形成主要分子间作用力
3 蛋白冠的预防措施及利用方法
PC可以增强NPs的生物稳定性和相容性,改变NPs与免疫系统的相互作用,影响NPs的细胞摄取和细胞毒性。但PC也可能干扰靶向配体与组织特异性受体的相互作用,从而影响药物递送效率。此外,蛋白冠还可能影响纳米材料在体内的分布和代谢。近年来为避免和改善PC带来的影响,学者们使用特定抗体或配体进行功能化、预先涂覆功能蛋白质、修饰官能团吸引特定蛋白质以及利用特殊蛋白冠来增强纳米粒子的递送效果。为了防止PC的形成,常用的方法是通过接枝亲水聚合物(例如PEG)来修饰纳米粒子表面,形成水合层,防止蛋白质吸附,这被称为“隐形”效应[84]。聚合物的密度、分子量和链结构影响隐形效应的有效性。除了PEG外,还有其他替代的隐形聚合物,如聚甜菜碱、聚丙烯酰胺接枝瓜尔胶等,它们通过静电相互作用或其他机制来抵抗蛋白质吸附[85]。天然来源的聚合物,如透明质酸和多糖,也被研究作为潜在的隐形聚合物,可以降低蛋白质吸附,同时可能降低NPs的免疫原性[86]。使用抗体或配体对纳米粒子表面进行功能化,可以实现靶向输送[87]。另一方面,PC的形成可能会影响配体-受体相互作用,因此需要采取措施来减少这种影响,如通过用额外的PEG靶向配体填充PC未占据的纳米粒子表面[88]。
白蛋白和载脂蛋白是常用的涂覆功能蛋白质。白蛋白是血浆中最丰富的蛋白质,被广泛应用于NPs的设计中,旨在提高胶体稳定性、减少非特异性细胞摄取,并延长NPs的循环半衰期。白蛋白可以与其他蛋白质(如糖蛋白或细胞外基质蛋白)相互作用,促进NPs递送至靶组织。预先涂覆白蛋白是通过将NPs与白蛋白一起孵育,使其物理吸附到NPs表面而实现的。研究发现,使用白蛋白预包被的NPs在黑色素瘤细胞中的细胞摄取方面表现出更好的效果,显示出比未包被的对照更高的生物利用度、肿瘤分布和抗肿瘤功效[89]。载脂蛋白在NPs设计中的应用主要涉及其促进NPs穿过脑内皮的运输,如ApoE等载脂蛋白的涂层可增强NPs的脑向性[90]。近年来对于PC的最新研究集中于使对NPs进行表面修饰使其吸引特定蛋白,形成具有特殊功能的PC。Kim等[91]使用多巴胺涂覆介孔SiO2 NPs吸引白蛋白,增强siRNA传递以抑制肿瘤生长。Li等[92]设计马来酰亚胺修饰的PLGA NPs与白蛋白结合,增强血液循环并减弱肿瘤积累。Göppert等[93]制备出聚山梨酯稳定的NP吸引载脂蛋白结合,并促进它们通过LDLR输送到大脑。随后Prabhaka等[94]采用聚山梨醇酯80作为NPs载体的表面改性剂,以改善药物向大脑的输送。Chen等[95]在脂质体纳米粒(lipid nanoparticle, LNP)表面修饰了正电荷,吸引了玻连蛋白,提高了细胞摄取,尤其是α3阳性细胞。Santi等[96]设计促使转铁蛋白结合肽与Au NPs原位结合,增加了转铁蛋白受体表达细胞对NP的摄取。Zhang等[97]制备含有聚乙烯亚胺涂层的纳米颗粒(RCP NPs)吸引了视黄醇结合蛋白和白蛋白,其中蛋白质结合阻止了NPs的聚集,并导致细胞摄取谱偏向于肝星状细胞。RCP NPs进入肝脏中的肝星状细胞,并将下调胶原蛋白的反义寡核苷酸递送至肝星状细胞以减少肝纤维化。
通过对纳米粒子表面的蛋白进行选择性设计,可以提高纳米粒子向靶向器官的递送效果。Zhang等[98]使用短肽装饰的脂质体捕获血浆中的载脂蛋白A1、载脂蛋白E和载脂蛋白J,实现对脑肿瘤的短干扰RNA递送,并在外泌体模拟物表面修饰二硬脂酰基磷脂酰乙醇胺-聚乙二醇-多肽,通过与脂蛋白受体相关蛋白1的相互作用促进血脑屏障转运,将多西紫杉醇递送至胶质母细胞瘤。通过控制表面成分,如阳离子脂质体和DNA复合物的DNA涂层,可以改善NPs的PC轮廓,提高对肿瘤的递送效果[99-100]。对纳米晶体使用表面稳定剂,则会影响药物的药代动力学和生物分布曲线和抗肿瘤作用[101]。表面成分的不同结构导致PC特征的变化,影响LNP在体内的器官向性,Zhao等[102]研究发现咪唑基类脂质的LNP倾向于靶向脾脏,而尾部带有酯键的LNP则主要沉积在肺部。Shen等[103]研究发现葡聚糖包被的亚铁NPs可以通过激活凝集素补体途径靶向脾脏中的B细胞。Astarita等[104]将阳离子脂质复合物利用人造PC预功能化,改善角膜上皮细胞的摄取,提高在眼球内的递送效果。
在许多情况下,不受控制的PC会干扰纳米粒子NPs的预期功能,导致NPs在体内积累、免疫反应受损以及靶向特异性相互作用的丧失。与此同时,血液中存在一些特定的蛋白质,如白蛋白、转铁蛋白和载脂蛋白,它们能够增强NPs向特定器官的输送。因此,可以合理地设想使用所需的蛋白对NPs进行预功能化,或通过工程设计表面以优先在原位选择这些蛋白质进行结合。
针对PC的研究应用仍然面临许多挑战。首先,由于医疗条件和疾病的不同,特定蛋白质的含量存在很大差异。其次,蛋白质的变异性可能会破坏基于人群的研究确定的PC效用。第三,对非蛋白质生物分子在纳米粒子性能中的作用了解有限。因此,未来的研究需要深入了解非蛋白质冠的功能以及其成分之间的相互作用。可以结合计算机辅助预测PC与NPs的相互作用,并根据每个患者的情况定制NPs的设计。最后,虽然PC分析已成为NPs表征的常见做法,但大多数研究依赖于动物源血清中NPs的体外培养。目前的方法在许多方面都存在局限性。血液蛋白质成分因物种而异,因此通过动物血清获得的信息可能无法推广到人类。体外研究通常在静态条件下进行,无法考虑可能影响PC与NPs相互作用的血流剪切应力。此外,PC的分析主要集中在HC的研究,而没有反映在循环中不断重塑的SC的功能。因此,为了准确预测PC与NPs相互作用以及进行相应的纳米粒子设计,需要发展能够反映体内动态条件的稳健体外方法。 purimag 系列可作为研究该过程的重要工具(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)。
4 展望
PC已成为反映NPs行为的标签,由于NPs在人体内形成PC会产生潜在的风险和不确定的影响,近年来对PC的研究备受关注。PC对NPs的影响体现在诸多领域:例如生物成像、生物传感、药物输送、诊断和治疗等生物医学领域,生物传感器、肥料和生长促进剂等农业领域,以及营养载体、食品添加剂和功能性食品等食品领域。因此,了解PC的形成机制和影响因素对理解和预测其体外和活体反应至关重要。本文回顾了近年来对PC形成机制及影响因素的研究进展,主要介绍了NPs特性、环境因素以及分子间作用力三方面的影响,同时对PC的预防和利用进行了总结。了解蛋白冠的形成机制和影响因素会帮助我们理解蛋白冠的形成过程并针对特定需求来控制特定蛋白冠的形成。虽然在PC的表征方面已经取得了重大进展,但影响PC结构的时间、环境变化以及蛋白质的竞争性吸附/解吸所带来的影响仍需进行大量的研究。鉴于PC的复杂性,需要更详细地研究以下方面。首先,要跟踪PC成分在运输过程中的动态变化,研究蛋白质在NPs上的结构、特性和停留时间。其次,NPs表面PC所形成的生物界面可能会在细胞、组织、器官的层面上引发特殊反应,需要了解PC如何诱导细胞免疫反应,并针对不同需求制定不同功能的NPs。最后,应加强对PC差异的研究,解决不同物种、患有不同疾病人群的血液环境改变以及蛋白质变异性导致的PC变化,发展能够反映体内动态条件的稳健体外方法。根据进入人体后产生的不同生物、化学反应选择适合的NPs。对PC的认识仍处于起步阶段,对PC的生物效应的研究仅局限于个体,很少有总体的客观规律。现在迫切需要了解PC对生理系统的影响,以减轻潜在的危害。未来,我们可以通过一系列的实验和模拟研究,进一步探究蛋白冠形成机制和影响因素。例如利用高分辨率的成像技术来观察蛋白冠结构的细节,并进一步研究其组装动力学和三维结构。此外,还可以基于计算机模拟和机器学习技术,来预测蛋白质突变对PC结构的影响。
purimag 系列可作为研究该过程的重要工具(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)。
- 上一篇:磷酸化蛋白/磷酸化肽段富集与分离方法研究最新进展 2024/11/9
- 下一篇:影响纳米材料表界面蛋白冠Corona形成的主要因素探讨 2024/11/5
