影响纳米材料表界面蛋白冠Corona形成的主要因素探讨
前言
随着纳米载体的生物医学应用的不断发展,从分子水平上理解纳米载体的体内过程极具必要性。纳米载体进入体液后,可以吸附蛋白质到其表面形成组织吸附层,即蛋白冠(Protein Corana)。蛋白冠能够影响纳米载体的理化性质和后继的生物学行为。因此,深入理解纳米载体表面蛋白冠的特征和影响是调控其体内命运的首要步骤。2022年5月,美国塔夫茨大学生物医学工程系的许巧兵教授等在Advanced Drug Delivery Reviews发表综述,总结了纳米载体的蛋白冠对其体内命运的影响,并提出了合理调控纳米载体的蛋白冠,实现其体内命运调控,完成合适的生物医学过程的设计策略。厦门普睿迈格生物科技有限公司开发的磁珠(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)在血浆和血清的蛋白组学研究中,具有优异的表现,已成为血液蛋白组学前处理的最常用工具.
介绍
过去几十年里,纳米乳液、脂质体、聚合物纳米粒子等多种纳米载体已成功用于治疗剂的高效递送。然而,由于纳米粒子(NP)和生物分子之间存在复杂的相互作用,仅有一小部分纳米药物达到临床预期要求并成功上市。1950年代和60年代初,Bangham和Vroman开创了“蛋白质吸附”的相关工作。Dawson等研究了蛋白质与粒子之间的相互作用,并于 2007年提出了“蛋白冠(PC)”的概念。随着纳米递送系统的发展,由于这些外源性纳米粒子可以和生物体液中天然存在的蛋白质相互作用,从而在其外表面形成PC,PC再次成为一项重大挑战。这一过程受到各种生理和病理条件定性及定量的影响,严重影响药物载体的稳定性、有效性和安全性。目前,许多研究集中于研究PC的形成机制、特征、对纳米粒子性质和体内命运的影响,以及利用这种现象的潜在策略。
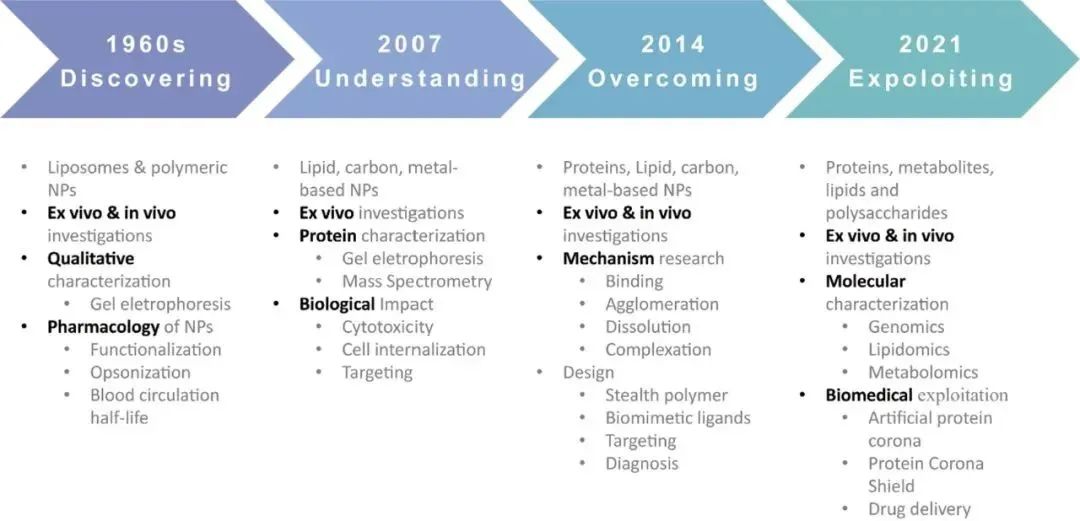
图:蛋白冠的研究进程
蛋白冠(PC)介绍
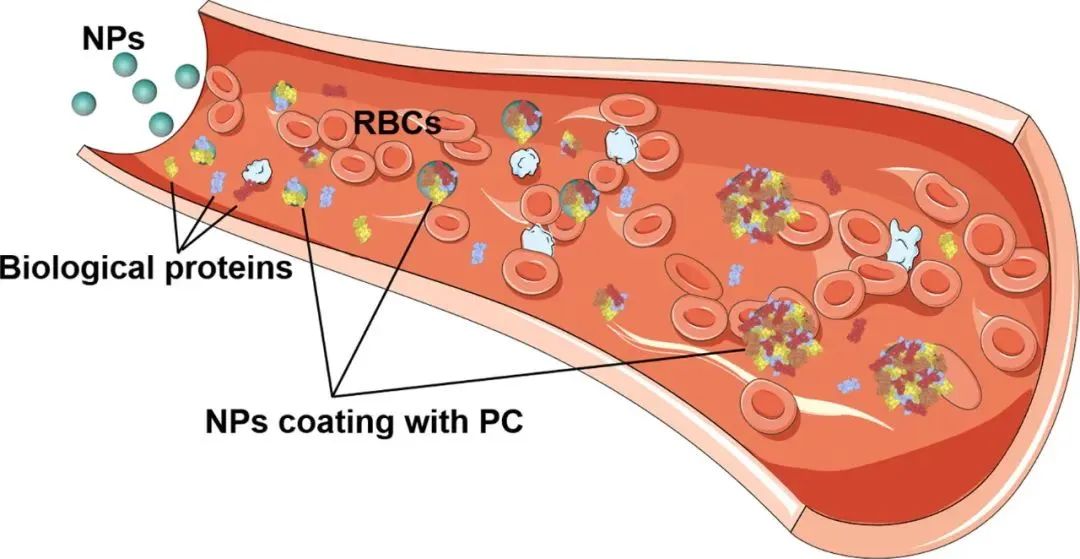
图:纳米粒子在体内过程
纳米粒子(NP)在生理环境中会遇到许多成分,并产生多种相互作用,进而可能显著改变NP 的性质和行为,包括形态、直径、稳定性和体内命运。血清是一种复杂的液体,含有超过3700 种蛋白质,浓度为0.07g/mL。血浆蛋白是生物体液中含量最丰富的成分,其循环过程中可吸附到NP表面,并通过静电、范德华和疏水相互作用形成称为“PC”的涂层。PC的形成是一个动态过程,其中丰度高的蛋白质包裹在纳米颗粒周围,形成低结合亲和力蛋白质的松散结构,即“软冠”。然后,丰度较低、结合亲和力较高的蛋白质逐渐取代它们,形成“硬冠”。由于与吸附蛋白质的热力学有利相互作用,结合亲和力较低的蛋白质与PC结合。然而,PC蛋白之间的相互作用可能导致蛋白质的二级和/或三级结构的构象变化。疏水性、表面修饰、形态、电荷和结合位点都是可能影响蛋白质与NP结合的因素。预测NP生理功能的能力很大程度上依赖于蛋白质的表征。
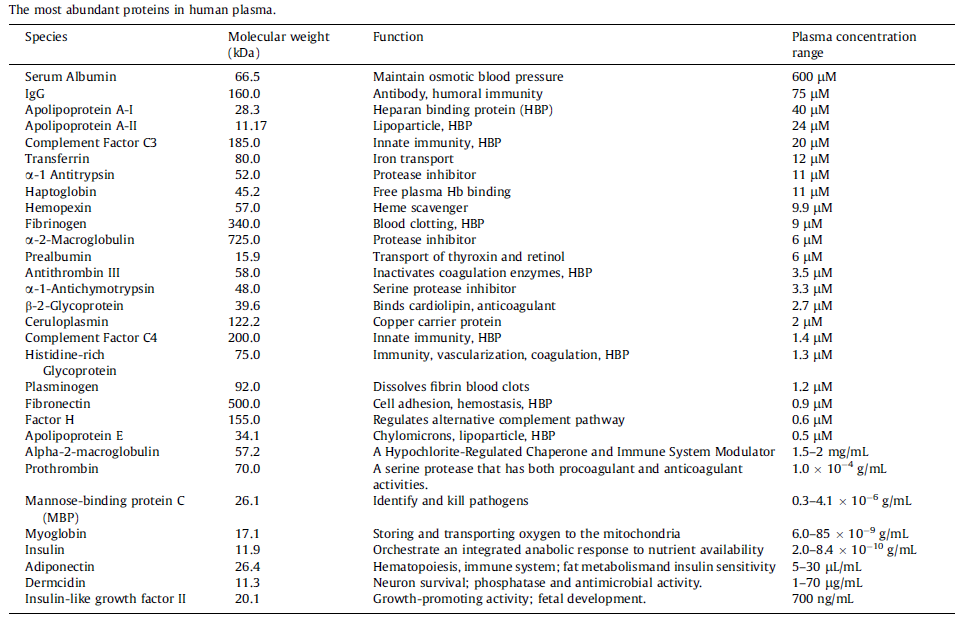
图:人血浆中含量最丰富的蛋白质
PC形成的影响因素
影响PC形成的因素包括NP特性和温度、pH、剪切力、循环时间、疾病条件和动物种类等外部因素。
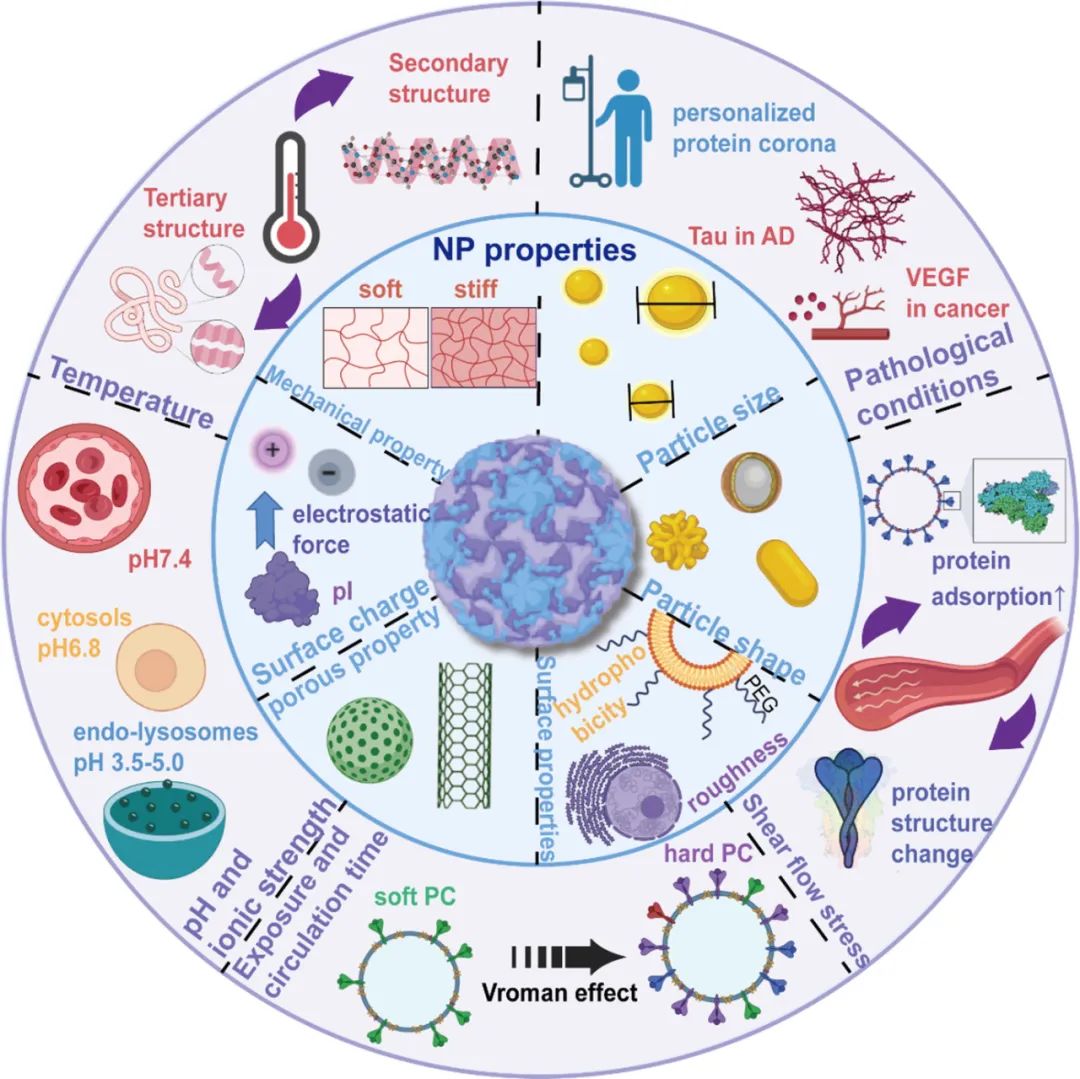
图:纳米粒子表面蛋白冠的形成
■ NP特性
NP的表面电荷、直径、疏水性、形态和刚性等物理化学性质很大程度上会影响PC的形成。粒径是NP的基本属性,由于接触面积增加,较大的NP通常比较小的NP吸附更多的蛋白质。Lima等报道聚合物NP上的PC形成具有尺寸依赖性(26、80和200nm),直径为80nm的羧化聚苯乙烯NP的蛋白质吸附能力优于其他两种NP,26nm的颗粒吸附的蛋白质则更少。相反,另一项研究表明,当测试直径为100和200 nm的聚乳酸-乙醇酸共聚物 (PLGA)/PLGA-PEG-NP时,蛋白质吸附受到所用聚合物的显著影响,而不是其尺寸。NP直径也会影响PC结构,如果NP的粒径过小,形成的PC会比较松散;而对于较大的纳米粒子,蛋白质可以多层紧密包裹在纳米粒子外表面上。Wu等使用具有不同尺寸(120、240、480nm)金纳米粒子和牛血清白蛋白(BSA)分析PC结构变化和细胞摄取的差异,研究了不同粒径对PC性能的影响。结果表明,当BSA与NP结合时,蛋白质中α-螺旋的含量增加,二级结构发生改变。然而,尺寸的影响可能会发生变化。Chan等发现,当暴露于血浆蛋白时,尺寸小于10nm的NP可以作为NP蛋白复合物中的货物而不是载体,在这种情况下,NP的性质不会影响复合物的一般结构。
颗粒形状是决定颗粒性能的关键参数,并深刻影响PC的形成和组成。Wang等探索了34nm纳米球(AuNSP)、48 x 14nm纳米棒(AuNR)和40nm纳米星(AuNS)等三种不同形状金纳米粒子(AuNP)对胰蛋白酶和纤维蛋白原蛋白冠的功能和结构的影响。结果发现,球形AuNP比棒状和星状AuNP更容易被PC覆盖,这对蛋白质二级结构的影响更大,并且与纤维蛋白原相比,胰蛋白酶促进了AuNP的聚集。通常,棒状NP比圆形NP吸附更多的蛋白质,笼形AuNP吸附的总冠蛋白较少。
NP的表面性质(粗糙度和疏水性)也会影响PC的形成。使用基于甘露糖、半乳糖和葡萄糖、聚(2-D-糖丙烯酸乙酯)-b-聚(丙烯酸正丁酯)-b-聚(4-乙烯基吡啶) (PSugEA-b-PBuA-b-P4VP)的六种ABC三嵌段三元共聚物,直径为130–160 nm的片状纳米颗粒, 研究粗糙度对蛋白质吸附的影响。与由聚(2-D-糖丙烯酸乙酯)-b-聚(丙烯酸正丁酯)-b-聚苯乙烯制备的光滑NP相比,与血清培养基孵育后,贴片状NP的蛋白质吸收要少得多。
此外,结合在NP表面的白蛋白数量取决于糖的类型。基于葡萄糖的颗粒吸附80%的白蛋白;而基于甘露糖和半乳糖的NP分别仅吸附50%和30%的白蛋白。NP表面疏水性的增加也可能促进PC的形成。Lindma等通过调节N-异丙基丙烯酰胺/N-叔丁基丙烯酰胺共聚单体的比例开发了一种具有不同疏水性的纳米颗粒,含有25%或更少丁基丙烯酰胺的 200 nm颗粒几乎没有吸附人血清白蛋白(HSA),而含有>35%丁基丙烯酰胺的颗粒完全被HSA覆盖。而疏水性聚合物210-nm NP倾向于被免疫系统蛋白调理到比亲水性NP更低的程度。此外,NP表面末端基团也会影响PC的形成。例如,酸封端的PLGA-NP比酯封端的结合蛋白数量增加。聚乙二醇化还可以通过减少纳米颗粒上的蛋白质吸附来改善药物载体的循环时间,这归因于其亲水性和非离子性质。静脉注射后,聚乙二醇化的NP倾向于结合更多的低分子量和丰度较低的血浆蛋白。特定蛋白质如载脂蛋白E(ApoE)的结合则受到PEG密度的影响。ApoE吸附在55,90和140 nm大小的NP中随着PEG密度超过20 个PEG5k链/100nm2而减少。尽管增加PEG分子量和链长可能会降低蛋白质吸附,但PEG-NP已被证明在重复给药后诱导抗PEG抗体的形成,从而加速血浆清除(ABC)。少于非PEG化NP的PC涂层可以防止PEG分子免受免疫识别,从而减少抗PEG抗体的产生。因此,应该优化调整PEG密度、长度和脱落率,以同时改善循环时间,最小化ABC效应。Suzuki等发现使用具有短酰基链的PEG脂质可以加速PEG脱落,显著降低抗PEG抗体的产生。此外,用羟基和两性离子聚合物(如聚甜菜碱和多糖)修饰的NP对PC的形成具有定量和定性的影响。
此外,多孔性对PC组成也有深远的影响。多孔NP可以结合更多分子量小于50 kDa的蛋白质(如ApoA-II),相比于致密NP,这些蛋白可以更好地渗透NP内部区域。研究人员发现,小蛋白质控制着小孔径介孔二氧化硅纳米粒子(MSN)的PC,孔径为14 nm的MSN与致密的MSN具有相似的PC组成,而孔径<7.4 nm的MSN表现出显著的蛋白质模式差异。
阳离子颗粒通常比阴离子和中性粒子具有更高的PC含量和蛋白质类型,主要由带负电荷蛋白质的静电力驱动。Bewersdorff等发现,当使用硫醇化PEG作为配体时,阴离子NP(如 AuNSP-COOH和AuNR-COOH)会产生更大的蛋白质结合亲和力,中性NP具有比金纳米星和金纳米笼更大的蛋白质数量。此外,PC的积累和组成受到蛋白质等电点(pI)的影响。pI-7.1富含组氨酸的糖蛋白、pI-6.6载脂蛋白B-100和pI-6.3补体C3都倾向于附着在带负电荷的NP上;而pI-5.5 ApoA-I倾向于在带正电的NP上积累。
NP的机械性能在PC形成中发挥关键作用。Zhao等制备了直径为150-180nm的二氧化硅纳米粒子,其杨氏模量范围为704kPa、25MPa、459MPa至9.7GPa。胎牛血清(FBS)孵育结果表明,刚性增加导致总蛋白质吸收增加。最刚性的NP含有大量的补体蛋白(如补体C3、I因子、H因子、α-1B-糖蛋白和免疫球蛋白),但保留的载脂蛋白较少。刚性会影响PC中蛋白质的分子量和pI。最刚性的9.7-GPa NP主要被分子量小于150 kDa和pI小于8的蛋白质覆盖。
■ 温度
身体不同部位及不同条件下的体温范围为35.8到37.2℃。温度是决定纳米粒子蛋白冠组成的另一个关键因素。加热会使溶液中的蛋白质变性并失活,形成沉淀。温度高于或低于37℃可能会改变蛋白质的二级和三级结构,影响蛋白质在NP上的吸附。Wolfgang等报道了白蛋白、α-2-HS-糖蛋白、血清转铁蛋白、ApoA-I等血清蛋白可以形成温度依赖性的蛋白冠。例如,40°C时,α-2-HS-糖蛋白与带正电荷的79-nm NP的结合最多。金纳米粒上PC的形成归因于非硫蛋白静电力或硫蛋白金硫共价键,而温度主要影响硫蛋白结构(b-乳球蛋白,b-lg)。Huang等发现当温度升高时,Au-S键的作用力减弱,蛋白质吸附量减少,NP直径减小。温度也会影响蛋白质对金纳米粒子的吸附速度。例如,AuNP-β-lg冠的Au-S键形成时间在4℃时为12h,但在24℃时缩短为9h,在44℃时缩短为6 h。当温度超过其较低的临界溶液温度(LCST)时,其热响应材料出现“塌缩”和溶剂化状态较少,因此热响应NP的蛋白质亲和力通常会升高。例如,N-异丙基丙烯酰胺(NIPAm)共聚物NP-肝素的结合常数从15℃时的1.2 x 106M(低于LCST)增加到35℃时的2.5 x 106 M(高于LCST),原因在于肝素取代了NP中的水分子。BSA、人免疫球蛋白(Ig)G、纤维蛋白原等蛋白质在37℃下聚[2-(2-甲氧基-乙氧基)乙基甲基丙烯酸酯]上的结合蛋白量比25℃时增加1.5-2.5倍。
■ pH值和离子强度
身体不同部位的pH值差异很大(胃:pH 1.5–2,血液:pH 7.4,大肠:pH 8)。NP在细胞摄取过程中会经历多次pH转变,从细胞外环境中的pH 7.4到细胞质中的pH 6.8,再到内溶酶体内的pH 3.5-5.0。因此,pH对PC形成的具有重要影响,因为它会影响表面电荷、蛋白质结构和分子相互作用。pH 7.4时范德华力和氢键相互作用增加,而在pH 6.0时主要发生静电相互作用。此外,pH还影响蛋白质和NP的表面电荷和结构变化。例如,更多的BSA(pI 4.7)在pH 6.0时与脂质-NP的静电相互作用比在pH 7.4时更强,因为在较低pH 时BSA上的额外正电荷有助于其吸附。PC的形成也受到氨基酸电荷变化的影响。带负电荷的羧酸盐修饰的NP在低pH(即5.5)下与IgG-Fc结构域的质子化组氨酸相关,而组氨酸在pH 7.4下为中性;因此,NP-IgG的静电相互作用受到损害。对温度敏感的NIPAm-NP在pH 6.5时与IgG相关,并且在pH 7.3时解离。
离子强度因生物体区域和生物流体的不同而异。例如,胆汁为3–15 mM,血浆为150 mM,红细胞为200–250 mM。血浆蛋白在不同的缓冲液中可以暴露不同的结合位点。在不同pH值(6.0、6.6和7.5)和离子强度(0.15和0.30 M NaCl)下,研究了磷酸盐缓冲液对磁性氧化铁NP(MNP)上PC形成的影响。发现PC的稳定性随着pH和离子强度的增加而降低,在0.05 M的磷酸盐缓冲液和pH为6时具有最大稳定性。另有研究人员研究了缓冲液浓度对野生型β2m和柠檬酸盐涂覆的AuNP的PC的影响。发现低浓度缓冲液可以在NP上形成更紧密的蛋白质层,而高浓度缓冲液阻碍了蛋白质和NP的结合,因此离子强度的变化可以将不稳定的、短暂的软冠转变为硬冠,硬冠则可以在NP上持续很长时间。
■ 暴露和循环时间
Vroman的研究表明,血清蛋白与矿物表面的结合是时间依赖性的。迁移率较高的蛋白质可能首先到达表面,然后在接下来的几个小时内被迁移率较低的蛋白质取代,长时间暴露后形成致密的PC,这种现象称为“Vroman效应”。一项研究测试了用含有10%FBS的细胞培养基孵育4-40nm大小的AuNP后PC的形成。发现延长孵育时间有助于NP吸附,并使PC从软冠转变为硬冠。例如,与10nm AuNP孵育几分钟形成不稳定的PC,而48小时或更长的孵育时间则形成持久性蛋白冠。然而,即使长时间孵育,在高负电荷的AuNP(10 nm,-57 mV)上也没有形成硬PC。Hadjidemetriou等研究了静脉注射聚乙二醇化阿霉素脂质体后的PC时间演变(10分钟-3小时)。结果表明,给药10分钟后形成的PC随着时间的推移发生了质的变化,但整体蛋白数量在研究期间没有明显变化。
■ 流体剪切应力
大多数NP通过静脉注射实现递送,因此它们暴露于不同流速的血液循环,从毛细血管中的0.085cm/s到动脉中的10cm/s以及主动脉中的60cm/s不等。血流引起的剪切压力在 0.5和30 dyne/cm2之间波动。许多研究表明,血流速度可以影响PC的结构和组成。高流速可以增强NP上的蛋白质吸附和PC形成。利用微流控将100nm的AuNP与人血浆混合可以得到更厚的PC,其主要由免疫球蛋白(30%)组成,且带有额外的负电荷。然而,静态混合时,PC成分主要为组织渗漏蛋白(26%)。此外,由于蛋白质疏水区的暴露和蛋白质水解的增加,蛋白质结构也可能在剪切压力作用下发生改变。例如,将流速从0.85 cm/s 改变为8.5 cm/s,血纤维蛋白溶酶原结构发生了很大变化。
剪切条件的影响情况也可能会受到NP表面性质的影响。Yu等在类动脉和静脉流动以及静态环境下利用血液循环模型研究了三种极度亲水的防污材料刷上的PC,包括聚(N,N-二甲基丙烯酰胺)(PDMA)、聚(2-甲基丙烯酰氧基乙基磷酰胆碱)(PMPC)和聚[N(2-羟丙基)甲基丙烯酰胺]( PHPMA)。结果表明,在流动环境下,PDMA刷可以吸附更多的凝血蛋白、玻连蛋白、补体蛋白、纤连蛋白和而结合更少的血清白蛋白。然而,吸附在PMPC和PHPMA刷上的PC的成分在静态和流动情况下是相似的。特别地,流动环境对PHPMA和PMPC笔刷形成的PC影响不大。此外,动态血流促进体内PC蛋白损失和蛋白交换。例如,将葡聚糖修饰的超顺磁性氧化铁纳米虫与人血浆预孵育后,静脉注射到小鼠体内后,迅速失去相关蛋白,特别是第三种补体成分。
■ 病理条件
血浆中蛋白质的类型可能在不同的患者和疾病中有所不同,表明即使使用相同的NP,形成的PC对于每个患者都是独一无二的,因此提出了出“个性化PC”(PPC)的概念。肿瘤环境下过表达的蛋白质,例如补体C3、血管内皮生长因子(VEGF)、富含组氨酸的糖蛋白、基质金属蛋白酶和 kininogen-1也可能影响PC的组成。Huo等将AuNP与正常血清或患者血清共孵育,然后通过与相应抗体孵育来分析蛋白质。结果发现,健康对照组的颗粒大小比荷瘤小鼠增加更多,但与非肿瘤样本相比,患者样本中AuNP的PC中发现的VEGF浓度较低。正常和肿瘤血清之间的显著差异是由于检测了血清蛋白复合物形式的VEGF而不是单个VEGF蛋白。前列腺癌早期PC中人IgG蛋白丰富。冠状涂层氧化石墨烯片的细胞反应和PC形成受不同患者血浆蛋白水平的影响。暴露于胰腺癌患者血浆后PC的结构和组成发生了显著变化。由于患者血浆中存在或富集IgA和IgG自身抗体,因此患者的样本中容易形成硬冠。与健康患者相比,将钆金属富勒烯醇NP与肺癌患者的血浆一起孵育导致补体成分(主要是C1q)的吸附升高。PC的这些定量和定性变化可归因于各种疾病的不同血浆蛋白质组学特征。Tavakol等研究了高血糖和高胆固醇血症对聚苯乙烯 NP周围PC组成的影响。结果表明,增加的葡萄糖/胆固醇对NP表面上的纤维蛋白原结合位点造成了相当大的改变。
PC对载体性质的影响
NP上PC的相互作用和形成是一个复杂的过程,NP的物理化学性质主要受PC的影响。因此,需要了解它们之间的相互作用,以获得具有合适粒径、形状以及适当疏水性/亲水性平衡的NP-PC复合物,以优化循环、渗透和体内稳定性。
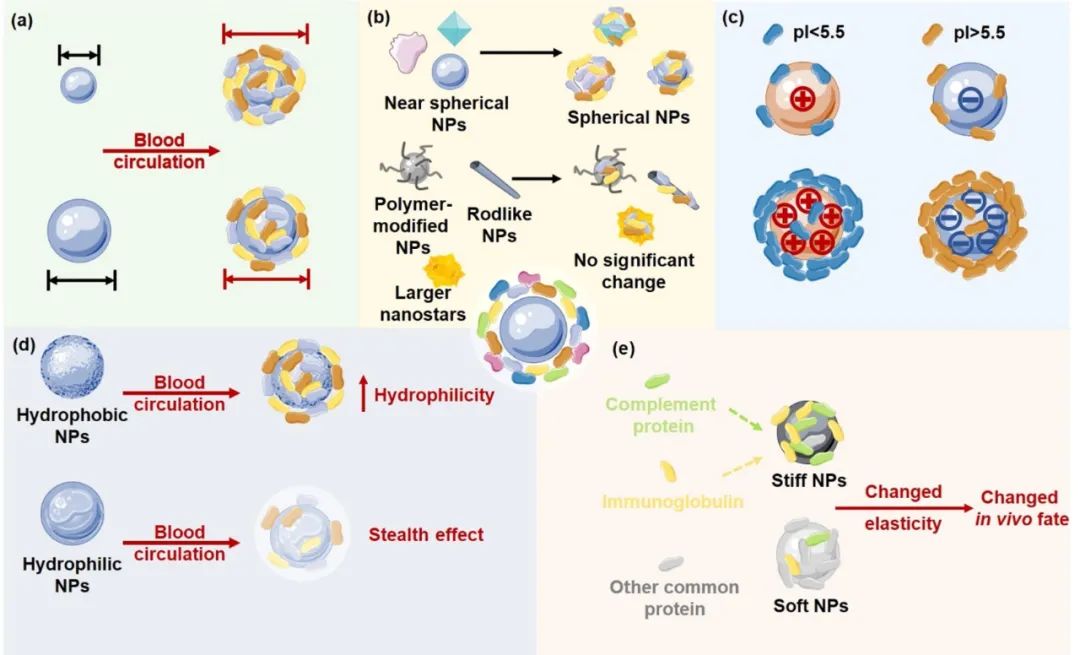
图:蛋白冠对纳米载体性质的影响
■ 粒径和形状的改变
当NP与周围环境中的生物成分相互作用时,它们的大小会显著增加,尺寸的变化也受载体特性的影响。许多研究表明,纳米粒子在与生物材料相互作用后会变大,从而影响它们的体内行为。例如,在体外与100%人血浆37°C下孵育1小时和静脉注射到小鼠体内形成PC后,PEG-聚苯乙烯NP(80 nm)或与转铁蛋白受体配体(83–92 nm)偶联的NP的大小会增加。同样,以小尺寸(30 nm)著称的异丙氧醇NP在含有蛋白质的培养基(如人血清和FBS)中孵育后会变得更大,这可以增加它们的细胞摄取并改善其成像应用。此外,Corbo等发现静脉注射后1小时,由于 PC 的形成,脂质体和白细胞体的直径分别从166 nm和173 nm 增加到354 nm和324 nm。Piella等报道,柠檬酸盐稳定的金纳米粒子周围的PC厚度主要取决于纳米粒子的大小。通常,暴露于含有10%FBS的DMEM 48小时后,NP尺寸从 5.5-139 nm增加到10-174 nm。同样,在吸附硬冠蛋白后,亲水性二氧化硅纳米粒子和疏水性羧基改性聚苯乙烯纳米粒子的流体动力学尺寸分别从70 nm和100 nm增加到106 nm和155 nm。
PC形成后,NP的形状也会受到影响,根据初始NP的形状而产生各种形状。首先,纳米立方体或接近球形的纳米颗粒在PC涂层后变成球形;球形NP在血液中保持其形状,但其粒径增加。其次,一些聚合物修饰的纳米粒子,如聚乙二醇化纳米粒子,在PC涂层后可能不会发生显着变化。第三,一些NP(如AuNR)在PC形成过程中不会改变它们的形状,尽管纳米棒上的蛋白质吸附量高于纳米球。第四,纳米星的重塑过程取决于粒径。例如,40 nm的纳米星在与血液蛋白相互作用后被重塑,而70 nm纳米星则没有。形状变化是至关重要的,因为NP的形状赋予了它特定的功能。例如,纳米棒很容易通过小窝体而不是溶酶体被内吞以避免降解。纳米星则采用网格蛋白介导和小窝介导的内吞途径进入细胞。
■ 表面电荷的改变
虽然NP的负电荷有利于在血液中循环,但正电荷利于细胞摄取。PC形成后,带负电和带正电的NP表面电荷会发生中和。粒子和蛋白质之间的相互作用驱动PC的形成,进一步诱导NP的表面电荷最终从正转变为负。Candace等发现阳离子和阴离子NP在与血清共孵育后无法区分,PC形成后两者都变成阴离子。在生物体液中,纳米材料与生物实体(包括细胞表面和血浆蛋白)的相互作用也受到纳米粒子表面电荷的影响,阴离子NP对pI > 5.5的蛋白质具有高亲和力,而阳离子纳米粒子对pI < 5.5的蛋白质具有更高的结合亲和力。虽然许多研究表明血液中的纳米颗粒结合蛋白质涉及构象变化,但与带电NP相比,中性NP中的蛋白质构象可以得到保护。NP较高的表面电荷增加了PC的厚度,从而增加了NP的直径和蛋白质的构象变化。
■ 疏水性和亲水性平衡的改变
亲水/疏水平衡决定了纳米粒子的载药量和生物相互作用。然而,PC可能会破坏这种平衡,影响NP的生物相容性和靶向能力。
最近研究表明,NP的疏水性对PC的形成有显着影响。Gessner等发现随着NP表面吸附血浆蛋白量的增加,NP疏水性降低。Krishnendu Saha等发现NP的疏水性随着NP表面载脂蛋白和免疫球蛋白数量的减少而增加。Krishnendu Saha等还假设血浆蛋白的覆盖中和了疏水性和亲水性NP表面,但疏水性NP比亲水性颗粒更快被调理。此外,PC组成还受NP的亲水性和疏水性的影响。 Cedervall和Gessner发现在PC发展过程中,疏水性NP对载脂蛋白具有更高的结合亲和力。然而,亲水性NP倾向于吸附纤维蛋白原和IgG。此外,血浆白蛋白倾向于附着在疏水性NP上而不是亲水性NP上。
疏水性或亲水性聚合物包被的纳米载体表面的蛋白质结合减少。NP的亲水性聚合物涂层赋予了“隐形效应”,从而减少了吸附蛋白质的数量并保护它们不被网状内皮系统(RES)识别。聚合物亲水性、蛋白质吸附和细胞相互作用之间存在很强的相关性。当聚合物疏水性增加时,抗调理蛋白的整体粘附性降低,而细胞摄取强烈增强。
■ 弹性改变
材料的稳定性以弹性为特征,用特定物理参数(如杨氏模量)量化。纳米载体的弹性在靶向、内吞作用和吞噬作用中发挥至关重要的作用。例如,较软的颗粒(0.18-1.35 MPa)具有延长的血液循环时间和增加的器官积累,这是由于较软的颗粒可变形为较少被巨噬细胞内化的形状。Anselmo等发现,在体外证,与硬颗粒(~3000 kPa)相比,较软的颗粒(~10 kPa)具有更长的循环时间和减少的巨噬细胞摄取。Tengjisi等制备了弹性模量范围为700 kPa至10 GPa的纳米胶囊,发现最硬的NP表现独特的PC,具有高浓度的免疫球蛋白和补体蛋白。通常,PC的形成受NP弹性的影响,而反过来PC又会改变NP的弹性并影响它们的体内命运。
本文总结了纳米粒子蛋白冠的形成、影响蛋白冠形成的因素以及蛋白冠对纳米粒子特性的影响。厦门普睿迈格生物科技有限公司提供研究蛋白冠用的生物磁珠(PuriMag蛋白冠前处理磁珠试剂盒|高深度蛋白质组学-生物磁珠专家)。
参考文献:
Qingqing Xiao, Makhloufi Zoulikha, Min Qiu, et al. The effects of protein corona on in vivo fate of nanocarriers. Advanced Drug Delivery Reviews 2022, 186, 114356.
- 上一篇:纳米粒子表面蛋白冠Corona的形成机制和关键影响因素分析 2024/11/5
- 下一篇:蛋白质印迹(western blot)缓冲液和储备液的配方 2024/10/25
