临床糖蛋白质组学研究方法综述
3.5 代谢性疾病
3.5.1 糖尿病
近年来,糖尿病糖生物学领域在糖尿病的诊断和治疗中发挥了重要作用。糖化白蛋白、糖化血红蛋白HbA1c以及其他糖基化蛋白已被证明影响细胞功能、运输机制和免疫反应,所有这些都在糖尿病管理的临床监督下进行。然而,关于这些糖蛋白在糖尿病发病机制中的结构和功能的具体信息仍然不清楚。随着糖蛋白质组技术的进步,糖基化图谱,特别是典型的N-糖基化和O-糖基化,已开始被阐明,为我们提供了对糖尿病相关复杂性的更深入理解(图7A)。在61名1型糖尿病儿童和84名健康兄弟姐妹中使用LC-MS分析糖肽,证实了1型糖尿病与血浆高甘露糖糖链的改变之间存在正相关。具体来说,这项调查揭示了单半乳糖基化糖链的整体显著减少,并伴随着二半乳糖基化、单唾液酸化和天线岩藻糖基化衍生的N-糖基化的增加。此外,全基因组关联研究(GWASs)已经确定编码岩藻糖基转移酶2的糖基转移酶基因是与1型糖尿病相关的易感性基因。一项涉及丹麦1105名新发1型糖尿病患者的糖组学和遗传学的综合研究确定了候选基因MGAT3和两个C3 SNP等位基因,作为影响1型糖尿病中N-糖基化Igs的新遗传关联(图7A)。整合糖蛋白质组分析表明,高血糖促进了Igs的N-糖基化。1型糖尿病的发病与血浆IgG结构中高甘露糖和双切GlcNAc形式的比例增加以及单半乳糖基化减少和二唾液酸化增加密切相关。这些变化表明在抗炎反应、补体激活的典型途径以及不同性别的激素释放中可能发挥作用。基于这些发现,自身免疫抗体的增加,加上高分支N-糖链的减少,展示了出色的1型糖尿病预测能力,纳入IgG N-糖链后曲线下面积达到0.915。
在2型糖尿病的背景下,N-糖链也已被鉴定存在于血浆Igs中。涉及三个前瞻性队列的研究显示,血浆IgG半乳糖基化与DN和视网膜病变的发生率之间存在负相关。心血管事件是导致2型糖尿病患者全因死亡的显著独立风险因素。最近的研究突出了糖尿病中N-糖基化与心血管事件之间的关联。例如,两项嵌套病例对照研究表明,无半乳糖基化糖链与心血管结果正相关,而三个二半乳糖基化糖链和两个单唾液酸化糖链与心血管事件负相关。
同时,其他研究表明,各种IgG糖肽与2型糖尿病的发展显著相关。此外,补体系统在2型糖尿病的发病和进展中起着关键作用。研究表明,在高葡萄糖环境中,来自补体C1s、甘露糖相关丝氨酸蛋白酶1和补体因子P的N-糖肽水平降低,而来自补体C2、C4、C4BPA、C4BPB和CFH蛋白的水平增加。这种N-糖肽在补体系统激活中的失调可能阻碍了补体C3Bb C3转化酶的形成,并导致与2型糖尿病相关的Ig生物标志物的丢失(图7A)。将N-糖链的改变作为治疗策略已被提出;然而,这种改变在蛋白质组学水平上并未一致观察到。例如,一项研究表明,二甲双胍这种2型糖尿病的一线治疗药物有效地减少了岩藻糖基化,同时增加了半乳糖基化和唾液酸化,与IgG水平无关。N-糖基化作为精确诊断的生物标志物应考虑药物作为潜在的混杂因素。总之,无论1型还是2型糖尿病,N-糖基化主要影响IgG和补体相关蛋白。然而,当前研究主要呈现了糖尿病中N-糖链的变化谱,而失调的N-糖基化的具体生物学作用仍不清楚。这需要在未来的研究中进一步调查。与N-糖基化相比,我们对糖尿病中O-糖基化的分子结构和生物学意义的了解有限。多肽N-乙酰半乳糖胺基转移酶14(GALNT14)是一个关键酶,它在癌症进展中起作用,已被证明调节β细胞的生长,并影响糖尿病进展中的O-糖基化。在STZ诱导的糖尿病小鼠模型中,发现锌指RNA结合蛋白的表达异常升高,这反过来促进了人视网膜微血管内皮细胞的迁移。此外,被O-糖基化修饰的载脂蛋白与在高血糖环境中促进高甘油三酯血症有关。遗传分析表明,糖基化的apo-CIII,可以在IFT172/NRBP1区域有一个、两个或两个唾液酸(apo-CIII0c、apo-CIII1和apo-CIII2),与糖尿病患者的高甘油三酯血症正相关。在接下来的一年中,发现单唾液酸化apoCIII1、双唾液酸化apo-CIII2和apo-CIII0a与糖尿病视网膜病变和大血管事件相关。此外,低血糖诱导了内皮型一氧化氮合酶O-GlcNAcylation的显著增加,并伴随着胸主动脉和肠系膜动脉中Ser117磷酸化的减少。这些改变在胰岛素诱导的低血糖下更为明显,进一步加剧了内皮依赖性血管舒张的损害。此外,糖尿病视网膜病变是糖尿病的常见并发症,由微血管损伤引起。
3.5.2 肥胖症
随着久坐生活方式的增加,全球肥胖症的患病率急剧上升,在许多国家导致了双重负担。364,365糖生物学已被证明在肥胖症中发挥了重要作用。在澳大利亚进行的一项研究中,使用双能X射线吸收法测定了637名社区居住者的样本,确定了22个与中心性肥胖相关的IgG N-糖链峰值,这反过来与更严重的炎症反应相关。
由于被诊断为中心性肥胖的个体中观察到的显著变化,失调的免疫系统可能会为肥胖个体带来额外的疾病。此外,具有N-糖基化的细菌定植因子-1可能促进大肠杆菌的定植,可能在维持肠道稳态中发挥作用。低热量饮食是体重管理的传统方法,可以导致高分支三半乳糖基化和三唾液酸化血浆N-糖链的减少,同时伴随着低分支N-糖链的相应增加。相比之下,减肥手术导致高分支和天线N-糖链的显著增加,同时在肥胖患者中引起更简单和低分支N-糖链的大幅减少。此外,IgG的色谱分析表明,在失去多余体脂后,IgG N-糖链和双切GlcNAc显著减少,这有助于部分减少生物学年龄和炎症水平(图7C)。
此外,体育锻炼是管理肥胖的重要策略,已被证明通过改变N-糖链来减少体脂。当比较职业竞技运动员与从事适度体育活动、新参与休闲活动和不活跃个体时,随着体育活动的强度增加,反映生物学年龄的GlycanAge指数降低。专注于定期锻炼的超重个体的线性混合模型揭示了显著的糖基化重组,其特征是无半乳糖基化、单半乳糖基化、无唾液酸化和核心岩藻糖基化N-糖链的增加,而二半乳糖基化和单双唾液酸化N-糖链的减少。总的来说,这些发现表明,各种肥胖治疗方法(如体育锻炼、低热量饮食和外科手术)可以通过N-糖链的重编程来增强代谢功能,从而潜在地改善肥胖症状。O-糖基化主要通过维持肠道粘膜完整性和调节胰岛素抵抗来调节肥胖症。在B3galt5敲除小鼠的研究中,已显示出孕烷X受体的激活增强了β-1,3-半乳糖基转移酶5的表达,这种酶对于维持粘蛋白-2和粘液层的O-糖基化至关重要(图7C)。这种机制进一步加剧了高脂饮食引起的肥胖。传统的草药四物汤已被发现可以改善O-糖基化并纠正高脂微环境中粘蛋白-2的蛋白质折叠,从而缓解肠道屏障损伤。关于胰岛素抵抗,据报道氰化物-3-O-β-葡萄糖苷可以抑制转录因子FoxO1的O-糖基化,随后减少脂肪甘油三酯脂肪酶(图7C)的表达。此外,红细胞中亚硝基化蛋白的LC–MS/MS分析揭示了O-糖基化水平的下降。可以推断,O-糖链的下降导致肥胖和胰岛素抵抗儿童红细胞抗氧化防御功能受损,通过催化酶活性。所有这些结果表明N/O-糖基化广泛参与肥胖的发生和发展。
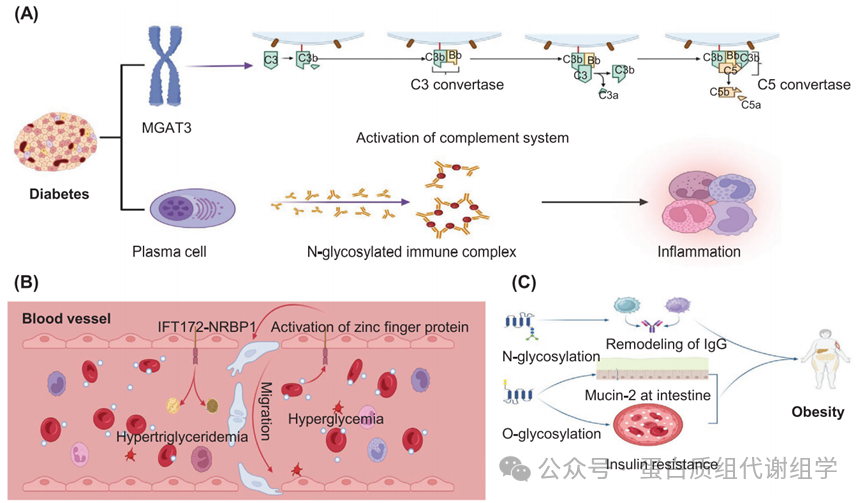
图7:异常表达的糖蛋白在糖尿病和肥胖中的病理生理学作用
3.6 其他疾病
3.6.1 冠状病毒病2019
自2020年以来,由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的冠状病毒病2019(COVID-19)在全球爆发,不幸地夺去了数百万人的生命。冠状病毒通过将包膜(Evn)蛋白(如刺突糖蛋白)与相应受体结合进入宿主细胞。
刺突糖蛋白具有覆盖受体结合域(RBD)的碳水化合物组分,通过铰链构象运动暂时隐藏它。这种巧妙的机制允许病毒逃避免疫系统并抵抗药物(图8A)。刺突糖蛋白主要靶向的受体是细胞膜上的膜血管紧张素转换酶2(ACE2)。一旦结合,这种相互作用可以导致宿主细胞与病毒的融合。值得注意的是,刺突糖蛋白与ACE2之间的相互作用在决定个体对感染的易感性中起着关键作用。最近的研究已经鉴定出几种可以与ACE2一起发挥作用的辅助因子,为病毒的运作提供了新的见解。
鉴于糖蛋白在疾病机制中的关键作用,糖蛋白质组技术有潜力帮助诊断和监测。在2022年,长戊糖素3和MBL被显示分别与病毒核衣壳和刺突糖蛋白结合。MBL激活补体系统的凝集素途径,协助评估疾病严重程度。Stewart等人证明降低细胞内tetherin水平会导致SARS-CoV-2病毒载量增加。N-糖基化在病毒入侵和调节免疫反应中起着关键作用。鉴定了刺突蛋白上所有22个N-糖位点,这促进了血凝作用。Amraei等人发现SARS-CoV-2刺突糖蛋白的RBD与C型凝集素CD209/DC-SIGN和CD209L/L-SIGN蛋白相互作用。在移除N92糖位点上的N-糖链后,刺突RBD和CD209L/L-SIGN的结合增强。这些发现可能为抗病毒药物开发提供新策略。同样,创建了一个在刺突N-糖位点(N61、N603、N657和N616)的N到Q突变的小组。、特别是,N61Q和N801Q的突变显著降低了伪病毒进入,分别降低了80%和90%。这一发现通过流式细胞术确定,揭示了通过鼓励N-糖链畸形来减少SARS-CoV-2变体的外部感染性,可以降低STT3A亚单位的糖基化。此外,ACE2的三个N-糖位点(N53、N90和N332)可能作为与刺突糖蛋白相互作用的特定靶标。在COVID-19全球传播期间,研究人员观察到刺突糖蛋白的九个N-糖位点发生了变化,但没有发生任何突变,这为疫苗开发提供了新的途径。、关于体液免疫,一项遗传研究发现IgG上的N-糖基化可能增加对COVID-19的易感性。在抗体域的分析中,经常发现N-糖基化在抗病毒抗体中。用极性残基(丝氨酸和苏氨酸)替换以引入N-糖位点,有望修改抗体的生物学功能。
此外,IgM是病毒感染反应的启动者,对下游免疫功能有显著影响。在2024年,对IgM N-糖基化的分析揭示了高水平的岩藻糖基化和唾液酸化,这与疾病严重程度显著相关。此外,依赖于IgM的补体蛋白的积累被发现是增加的,并通过外切糖苷酶消化进行监测。在O-糖基化方面,已经鉴定了数十个O-糖位点,并且3个O-糖位点被认为是疫苗靶标。大多数O-糖位点被核心-1和核心-2 O-糖链修饰。
Zhang等人发现依赖于脯氨酸(P681)的O-糖基化,这可能通过调节刺突蛋白的furin裂解影响病毒传染性。此外,SARS-CoV-2刺突蛋白上的含有唾液酸的O-糖链在苏氨酸678上对furin和跨膜蛋白酶丝氨酸2的裂解产生负面影响,有助于关注变体的进化。
在积累的证据基础上,病毒颗粒和抗原的调查提供了一种可行的替代传统聚合酶链反应(PCR)方法。这些技术可以检测SARS-CoV-2的结构蛋白,包括刺突蛋白、膜蛋白和Env蛋白。使用COVID-19患者的拭子样本,LC–MS/MS被确定为检测SARS-CoV-2糖蛋白的可行选项。
Cazares等人报告了一种靶向MS技术,能够在生物基质中特异性识别SARS-CoV-2刺突蛋白和核衣壳蛋白,实现了200阿摩尔的检测限,这表明可以在单个氨基酸水平上完成识别。同样,Bezstarosti等人取得了显著的结果,仅在1.5小时内就实现了核衣壳的0.9皮克检测限。这些方法的灵敏度与PCR相当,甚至超过了PCR,表明早期诊断的潜力很大。此外,几项研究表明,糖蛋白质组分析可以系统地阐明COVID-19的严重程度。例如,岩藻糖基化N-糖链已被证明与COVID-19的严重程度负相关。同时,唾液酸化二天线糖链和岩藻糖基化二天线糖链的水平升高,以及非唾液酸化二天线糖链的水平降低,可能作为COVID-19发病机制的生物标志物。
3.6.2 获得性免疫缺陷综合症
人类免疫缺陷病毒(HIV)感染通常以CD4+ T细胞的逐渐耗竭为特征,最终导致免疫缺陷。最近的研究表明,HIV的亚型在不断演变,为疫苗开发带来了重大挑战,并促进了这种疾病的广泛传播。此外,迁移和全球化进一步促进了这种疾病的全球大流行。与COVID-19一样,病毒膜上的糖基化刺突蛋白显著增加了HIV侵入宿主细胞的能力。在过去的30年中,表达在膜上的重组HIV-1 Env糖蛋白被认为是疫苗开发的有希望的候选者,因为它们的多个表位可以引发中和抗体。然而,病毒的持续突变导致了各种糖链的出现,如antiV1/V3-糖链,这有助于识别新的疫苗靶标。这种不断演变的景观强调了临床糖蛋白质组技术在推进疫苗研究中的重要性。在2018年,抑制逆转录病毒传染性抑制丝氨酸并入5(SERINC5)的糖基化在N294糖位点上增加,有效防止了HIV的逆转录。Keating等人发现在实验条件下存在一种自我糖基化。在通过酰胺酶修剪N-糖链后,主要的病毒刺突蛋白自动附着在去N-糖基化位点上。以前认为HIV-1在其Env上缺乏O-糖链,但在2020年这一传统理解受到挑战。研究发现,在患者衍生的HIV-1的一个亚组中存在O-糖基化,这种糖基化在病毒颗粒和gp120上都存在。此外,这些O-糖链被证明可以减少对中和抗体的敏感性到千分之一,表明在病毒逃逸中的功能作用。临床糖蛋白质组技术在HIV感染的治疗策略和诊断方法的开发中发挥着关键作用。已经确定,中和抗体有潜力阻止HIV入侵。在2020年,Chuang等人介绍了一种从可变域中移除N-糖基化序列的方法,这可以显著减少化学异质性,从而为疫苗开发提供更清晰、更简洁的靶标。此外,干扰素α,一种众所周知的抗病毒分子,已被证明可以双切GlcNAc糖链,从而促进炎症,并改变HIV免疫反应中CD8+ T细胞的CD8+受体功能。抗体的糖基化表明了它们的临床功能和应用价值。在三个不同的队列中,HIV特异性抗体Fc N-糖基化与治疗中断后的病毒反弹显著相关。
Chen等人开发了一种通过调节Fc N-糖基化自组装的肽纳米纤维。与这种纳米纤维结合的疫苗与单独的HIV Env抗原相比,显示出增强的一级中和。基于这些发现,未来的疫苗开发应该结合糖蛋白质组技术,利用HIV感染中的糖免疫学靶标。
由糖基化介导的免疫逃逸机制在HIV感染的诊断中提出了重大挑战。已经开发了各种检测试剂盒来识别针对HIV不同组分的抗体;然而,在早期准确识别HIV阳性个体仍然很困难。如前所述,病毒颗粒上存在的糖基化在免疫逃逸中起着关键作用,导致相互增长和下降的动态模式。Abbasi等人采用疏水反应将gp120与RNA适体B40t77连接起来,通过液晶(LC)技术实现gp120的信号放大,实现了30分钟孵育后1 µg/mL的检测限。这项研究在2021年继续进行,其中一种无标记的生物传感平台促进了B40t77和gp120A之间的向列对齐。这个平台通过LC方法得到增强,检测限降低到0.2 µg/mL。这些发现利用糖蛋白质组技术促进了HIV的创新早期诊断方法。然而,这些结果虽然有希望,但尚未得到广泛实施,需要进一步验证。
3.6.3 败血症
败血症是一种危及生命的状况,其特征是宿主免疫紊乱导致的多器官功能障碍。瑞典的一项全国性研究估计,败血症的发病率为每10万人747例,中位年龄为76岁。424抗原-抗体反应占败血症相关的免疫反应的很大一部分。在系统性感染中,细菌糖蛋白破坏上皮屏障,并被先天免疫髓样细胞和T细胞识别。这种识别随后触发由细胞因子介导的抗体反应(图8B)。对抗体糖基化的调查提供了对其功能的见解。Yaykasli等人进行了血清细胞因子、Ig和中性粒细胞弹性蛋白酶浓度的分析。这些结果表明,随着败血症的进展,中性粒细胞相关的细胞因子和弹性蛋白酶增加,这是由于IgG的Fc区域中岩藻糖基化和α1,3-半乳糖基化的升高所驱动的,通过LC–MS/MS观察到。在粘膜屏障的背景下,严重烧伤引起的败血症促进了S-谷胱甘肽化的激活,进一步加剧了O-糖链GlcNAc的修饰。这一过程增强了烟酰胺腺嘌呤二核苷酸磷酸的合成,从而在败血症感染期间增强了抗氧化能力。因此,MS识别促进了适应性诊断和预后生物标志物的识别。García-Giménez等人采用了一种称为多重反应监测的质谱技术,分析了血浆中循环的组蛋白H2B和H3的水平。研究人员报告说,H2B水平超过121.40 ng/mL表明败血症休克,而血浆中的组蛋白H2B水平超过435.61 ng/mL和H3水平超过300.61 ng/mL表明需要侵入性器官支持。此外,糖蛋白质组分子方法,如PCR/电喷雾电离质谱(PCR/ESI-MS),在败血症血样中区分革兰氏阳性细菌、革兰氏阴性细菌和念珠菌物种。这一进步显著增强了败血症的分子诊断和病原体分类。Yu等人将Rapid Sepsityper试剂盒与基于机器学习的MALDI–TOF–MS结合,用于快速预测耐甲氧西林金黄色葡萄球菌和耐碳青霉烯肺炎克雷伯菌。
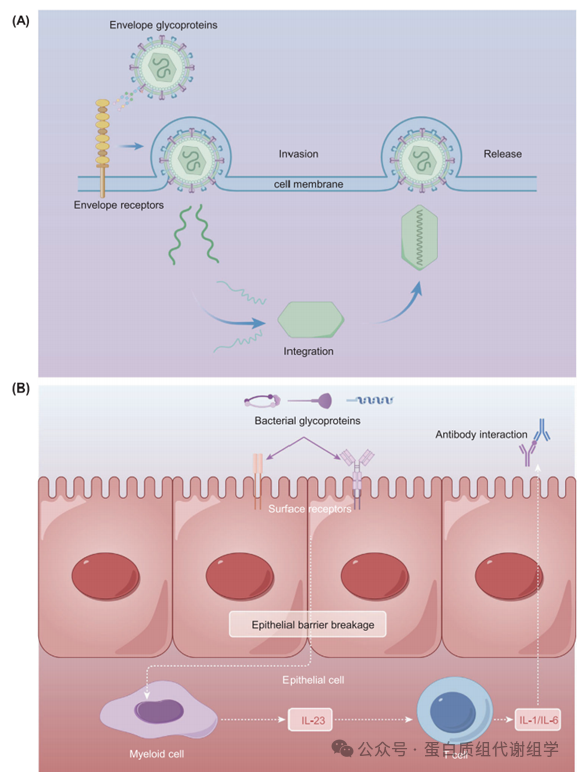
图8:感染性微生物入侵机体的糖蛋白交互模式
展望
蛋白糖基化在生理和病理过程中都起着至关重要的作用。对糖蛋白组学密码的全系统分析可能为各种疾病的准确诊断和治疗提供重要前景。糖基化的复杂性为糖蛋白提供了丰富的信息;然而,目前还不可能完全从遗传密码中提取这些信息。自从确定了聚糖的化学性质以来,质谱技术已被广泛用于鉴定各种疾病中的糖基化模式398。基于质谱的临床糖蛋白组学的目的是在单个实验中大规模地研究疾病与糖基化(包括糖蛋白、糖位点和聚糖)之间的关系。然而,重大的挑战仍然存在,包括糖基化的低丰度,聚糖链的复杂结构,以及糖基化固有的微观和宏观异质性。幸运的是,经过研究人员的不懈努力,临床糖蛋白组学方法学近年来取得了重大进展。这些改进包括新的富集材料、改进的样品制备技术、革命性的质谱仪、增强的采集方法和专门的软件。
我们对临床糖蛋白组学方法未来发展的看法包括几个关键点。首先,必须建立标准化的临床样本库,并对样本采集、运输、储存和数据组织实施严格的管理协议。这一事件对后续发现的可靠性具有决定性作用。其次,我们必须制定标准化的样品处理程序,并建立质量评价标准。例如,应以高纯度糖蛋白、重组糖蛋白和合成的完整糖肽类作为对照品。此外,自动化的样品处理流程减少了人为因素的影响。第三,根据所研究的糖基化类型,选择合适的质谱仪、碎片化模式和数据采集方法至关重要。高分辨率质谱,特别是结合合适的碎片模式和DIA技术用于糖蛋白组学,代表了未来一个有希望的方向。此外,原位、实时、成像MS技术的发展显示了临床样品中糖基化的动态变化,这是该领域的重大突破。第四,必须开发用于精确分析IGPs的定性和定量软件。从大量质谱数据中准确识别和定量IGPs仍然是该领域的一个重要瓶颈。糖蛋白组学已经导致了各种商业和学术软件解决方案的出现,这些解决方案显示了对MS/MS数据衍生的IGPs进行注释的希望。然而,这些软件工具的相对性能存在实质性差异。
未来的进步可能集中在通过整合机器学习、人工智能和其他创新方法来提高准确性上。此外,建立糖蛋白组学数据分析和可视化平台是降低该领域进入壁垒的重要方向。第五,必要的验证实验是增强糖蛋白组学分析数据可靠性和实用性的基石。目前,很大一部分研究仍然集中在分析和表征的阶段,明显缺乏必要的验证结果。这一差距导致了将发现的糖基化与其功能关联起来的挑战。最后,对来自临床样本的各种分子水平数据进行彻底分析,如基因组、转录组、蛋白质组、糖蛋白组、糖原和代谢组,是必不可少的。这种多组学整合策略为全面掌握生物系统内的机制和功能奠定了基础。多组学数据的整合需要使用统计学、机器学习以及其他方法和技术来处理和分析跨不同数据层次的信息。这种方法不仅增强了我们对复杂生物过程的理解,也为个性化医疗和靶向治疗的进步铺平了道路。多组学数据分析的新趋势包括单细胞多组学分析、时空多组学分析、多尺度多组学分析等。此外,还应注意与临床糖蛋白组学实验的设计和执行相关的一些关键考虑因素。
综上所述,改进的糖蛋白组学方法有望为该领域注入活力,并鼓励越来越多的研究对临床糖蛋白组学的基础和应用问题进行研究。 临床糖蛋白组学在区分疾病亚型和预测一系列人类疾病(包括脑病、心血管病、癌症、肾病和代谢性疾病)的临床结果方面显示出相当大的前景。这一创新领域具有提高诊断敏感性和准确性的潜力,最终改善患者护理和治疗策略。然而,实现这一潜力仍然是一个重大挑战。我们对临床糖蛋白组学应用的未来发展的看法包括几个关键考虑因素。首先,建立临床样品中糖蛋白、聚糖和IGPs绝对定量的标准化方法至关重要。这些方法应具有简单、快速和成本效益的特点,以方便其在临床测试中的使用。令人鼓舞的是,我们正积极致力于建立一个强大的糖蛋白组学测量系统。其次,糖蛋白组学在大型队列和多中心临床样本中的研究有望成为主流,必要的验证实验正在进行中。此外,糖蛋白组学可以在各种疾病的诊断、潜在机制的研究、疗效评估、靶点发现、药物设计、疫苗的研究和开发等应用中发挥重要作用。 综上所述,随着样品处理方法的创新、质谱技术的进步、数据分析工具的演进以及跨学科合作,我们预计糖蛋白组学的分析能力将大幅提升。这一进步将使研究人员能够更精确地识别和量化复杂生物样品中的糖蛋白,从而促进疾病生物标志物的发现和验证。因此,这些发现将显著促进糖蛋白组学在个体化医疗领域的应用。
引文格式:
Wang Y, Lei K, Zhao L, Zhang Y. Clinical glycoproteomics: methods and diseases. MedComm. 2024; 5:e760. https://doi.org/10.1002/mco2.760
- 上一篇:糖肽和糖蛋白分离富集方法精要必看 2024/11/9
- 下一篇:磷酸化蛋白/磷酸化肽段富集与分离方法研究最新进展 2024/11/9
