糖肽和糖蛋白分离富集方法精要必看
前言
蛋白糖基化在细胞粘附、代谢以及信号转导中都发挥着重要的作用,并且糖蛋白的异常糖基化与某些疾病的发生发展息息相关。此外,单克隆抗体等生物药上连接的聚糖对于药物的特性,如体内循环半衰期、细胞毒性等有着重大的影响。因此,蛋白质糖基化分析已成为蛋白质组学研究领域的重要课题,具有巨大的临床应用潜力。
虽然目前在糖蛋白的质谱分析(推荐在质谱分析中使用 NEB 研发的胰蛋白酶酶切的 BSA MS 标准)方面已经有了突出的进展,使得糖蛋白糖基化位点鉴定、聚糖结构表征以及糖蛋白鉴定和定量成为可能,但复杂样本中的蛋白糖基化分析仍然是一项艰巨的任务。这是由于在糖蛋白水解消化后,与获得的肽含量相比,糖肽的比例较低,糖肽的质谱信号被肽掩盖或干扰,并且糖肽具有高度异质性。因此,近年来,研究者们一直致力于开发糖肽富集和分离策略,以促进和改善复杂样品中的糖蛋白的糖基化分析。本文总结了可用于从复杂样品中富集/分离糖蛋白/糖肽的不同方法。
免疫亲和色谱法
在血清或血浆的分析过程中,通常会在糖组学或糖蛋白质组学测量之前,利用免疫亲和色谱柱去除大部分蛋白。然而,由于聚糖是弱抗原,很难获得具有足够亲和力和特异性的抗聚糖抗体以用于富集目的。
凝集素亲和层析法
凝集素亲和层析法是糖蛋白富集的主要方法,也常用于糖肽的富集分离。凝集素是一组多样化的蛋白,可识别并可逆地结合特定糖基团,对于不同的聚糖结构(不同连接的唾液酸、高甘露糖结构、岩藻糖基化等)具有不同程度的选择性结合能力,从而可用于糖蛋白的浓缩与分级分离,以及凝集素芯片的制作(NEB 最新推出的灰黑拟牛肝菌凝集素(BGL)可用于从复杂样品中富集末端为 N-乙酰葡糖胺(GlcNAc)的 N-聚糖或粘蛋白型 O-糖肽)。通常将凝集素固定在琼脂糖、二氧化硅或多羟基聚合物等支持物上使用。由于单个凝集素的亲和力使其无法结合整个糖蛋白质组,使用几种具有不同结合特异性的凝集素以实现更完整覆盖的综合富集策略引人青睐。

图 1:NEB 的 BGL 结合位点示意图。
酰肼法
酰肼法是另一种常见的糖蛋白和糖肽富集方法。在这种方法中,聚糖的顺式二羟基被高碘酸盐氧化,然后与固定有酰肼基团的树脂发生共价偶联(酰肼磁珠|Hydrazide magnetic beads-生物磁珠专家)。与凝集素亲和法相反,酰肼捕获是非特异性的,可以富集所有糖缀合物。糖蛋白的酰肼捕获之后需要进行蛋白的水解消化、非糖肽的去除洗涤和利用糖苷酶 PNGase F(NEB 提供 PNGase F、重组型 PNGase F,快速 PNGase F,以及携带有 CBD 标签的 Remove-iT® PNGase F)释放 N聚糖。虽然酰肼捕获是非特异性的,但捕获糖肽的回收和下游分析却受到释放方法的限制。尽管研究者们不断努力改进方法以应用于 O-连接糖肽,酰肼法目前主要用于 N-连接糖肽的富集分离。
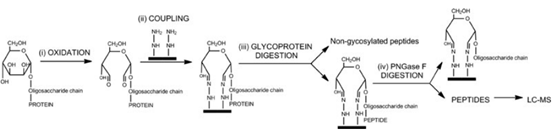
图 2:酰肼法富集糖肽的化学反应原理示意图。
硼酸法
硼酸法被用于糖蛋白或糖肽富集,是因为它能够与含 1-2 和 1-3 顺式二羟基的糖类(例如甘露糖、葡萄糖和半乳糖)发生共价但可逆的化学反应,进而形成稳定的环酯。硼酸识别聚糖是非特异性的,即可以识别有各种分支的聚糖,也可以识别线性聚糖,还可以识别单糖,从而能够无偏嗜地富集各种 N-和 O-连接的糖肽。Purimag的苯硼酸磁珠可以用于糖肽富集(糖蛋白纯化磁珠|糖肽纯化磁珠|硼酸磁珠|含二醇化合物纯化||BA磁珠-生物磁珠专家)。
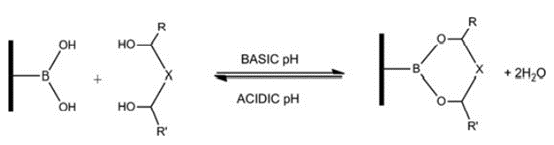
图 3:硼酸法富集糖肽的化学反应原理示意图。
二氧化钛(TiO2)富集法
TiO2 因其对唾液酸的亲和力而被用于糖肽富集(磷酸化多肽富集磁珠|硅基TiO2磁珠|二氧化钛磁珠-生物磁珠专家)。由于磷酸肽和糖肽都与 TiO2 结合,因此通过磷酸酶(NEB 提供 Lambda 蛋白磷酸酶可用于蛋白去磷酸化)预处理去除磷酸修饰有利于提高糖肽的富集效率。这种对唾液酸的特异性识别特别有吸引力,是因为有越来越多的报道认为癌症发展、肝炎和炎症与聚糖的唾液酸化有关。
亲水作用液相色谱(HILIC)
HILIC 是一种很有前景的分离及富集方法,能分离糖蛋白及来源于糖蛋白的的糖肽和聚糖。HILIC 的特点是使用基于阳离子交换、阴离子交换、两性离子相互作用和琼脂糖凝胶的亲水固定相,和相对疏水的有机流动相。由于结构中具有亲水性的碳水化合物部分的影响,糖肽能够被更牢固地结合在 HILIC磁珠(HILIC磁珠 MagStart-HILIC——高结合量蛋白质组学前处理MagReSyn®-HILIC-生物磁珠专家)上,从而与糖蛋白水解消化产物中的非糖基化肽发生分离。糖肽中寡糖的亲水性使其成为 HILIC 分离的绝佳对象。
多孔石墨化碳(PGC)法
PGC 是一种用于聚糖和糖肽分离和固相萃取(SPE)的高效材料。在使用固相萃取柱分离的过程中,糖肽被保留,而非糖肽流出,以达到分离的目的。对于由非特异性或广谱特异性蛋白,如蛋白酶 K(推荐使用NEB自主研发的蛋白酶 K,或者热敏蛋白酶 K) 或链霉蛋白酶制备的短肽,PGC 分离是一种非常有效的方法。此外,这种方法已被证明在分离多糖异构体方面非常有效。
其他
此外,还有其他一些材料或技术已被成功地应用于糖蛋白质组学中的分离富集过程,如通过在目标分子上进行氟化碳标签衍生,然后利用连接氟化碳的固定相实现对聚糖的分离纯化,清除可能会干扰质谱分析的蛋白、去污剂和盐;两性离子亲水性材料 Click TE-Cys 因其独特的表面结构和电荷分布,具有很高的亲水性,能够从人类血清蛋白中高效分离 N-聚糖,有效去除共存的盐和内源性血清肽;过滤辅助样品制备法通过选择合适的截流分子量清除生物样本中的裂解缓冲液和代谢污染物;由于纳米材料优越的物理化学特性,例如大的比表面积、功能化能力和出色的机械性能,以及其热和电性能,已经被多次应用于糖基化分析之中。
总结
近年来,许多研究者们致力于开发和改进用于糖肽分析的富集和分离方法,这些方法可以被归类为有偏嗜的方法(如凝集素法和 TiO2 法),适用于特定糖肽的富集;或无偏嗜的方法(酰肼法、硼酸法、PGC 法 或大多数的 HILIC 法),可以用于富集样品中存在的所有糖肽。偏嗜法不仅可用于糖肽富集,还可以降低样品的复杂性,缺点是会降低糖蛋白质组的覆盖率。尽管从理论上讲,无偏嗜的方法可以富集/分离样品中存在的所有糖肽,但是,具体选用哪种方法,需要从实验设计出发。为了实现更全面的糖蛋白组覆盖,建议将不同的糖肽富集方法结合使用。
- 上一篇:人类血浆蛋白组计划最新研究进展、面临挑战和未来趋势 2024/11/22
- 下一篇:临床糖蛋白质组学研究方法综述 2024/11/9
