临床糖蛋白质组学研究方法综述
3.3 癌症
癌症是全球健康的一大挑战,每年大约有1000万新病例和超过600万死亡病例。在各种癌症类型中,肺癌、结直肠癌、胃癌和乳腺癌尤为常见。206-208癌症的成因多种多样。生物科学的进步提高了我们对癌症的理解,突出了基因突变、感染和环境因素作为其发展的主要贡献因素。
为了揭开癌症的奥秘,研究人员已经确定了几个肿瘤衍生的生物标志物,包括基因、蛋白质及其修饰形式,如糖蛋白,以及代谢途径。这些发现在提高癌症的诊断和治疗方面至关重要。传统的癌症治疗包括手术、放疗和化疗。这些方法各自具有独特的临床益处和局限性,通常伴随着各种并发症。在过去几十年中,免疫疗法作为一种开创性和创新的治疗方式出现,其发展迅速,并在对抗肿瘤方面显示出显著的疗效。这种方法彻底改变了我们对癌症治疗的方法,强调了靶向分子疗法的重要性。这些疗法旨在破坏肿瘤细胞的代谢过程,导致其死亡,同时保留健康细胞。通过识别特定的分子靶标,这一精确性得以实现,而这一过程得益于组学技术的进步——包括基因组学、蛋白质组学和代谢组学。这些技术使我们能够详细分析异常反应、酶和细胞代谢产物,显著促进了我们对肿瘤生物学的理解以及有效抗癌药物的开发。
此外,随着研究深入探讨蛋白质与癌症之间的关系,糖蛋白质组学领域已成为焦点。糖蛋白,作为功能性蛋白质,已被确定为癌症起始和进展中的关键参与者。从研究这些糖蛋白中获得的见解不仅丰富了我们对疾病理解,还开辟了新的治疗干预途径。
图5显示了可作为不同癌症潜在诊断生物标志物和治疗靶点的糖蛋白,如肺癌、结直肠癌(CRC)、胃癌、乳腺癌、前列腺癌、胰腺癌、卵巢癌和肝癌。在以下部分中,我们将探讨糖蛋白质组学研究对我们理解癌症及其在开发新治疗策略中的应用的重要贡献。这一探索将强调精准医学在肿瘤学中的变革性影响,为全球患者提供更有效、侵入性更小的治疗选择带来希望。
3.3.1 肺癌
肺癌被普遍认为是全球健康的重要问题,其发病率和死亡率显著。它引起了广泛关注和研究努力。从病理学角度来看,肺癌可分为两种主要类型:小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。目前对NSCLC的治疗策略受到了越来越多的关注,因为SCLC机制的难以捉摸阻碍了药物开发工作。此外,值得注意的是,NSCLC有可能转变为SCLC,特别是在表现出表皮生长因子受体(EGFR)突变的患者中。237在遗传突变和异常蛋白质识别方面的开创性研究为分子靶向疗法的发展铺平了道路。这些疗法已显示出抑制肿瘤细胞增殖的疗效,标志着治疗肺癌的重大进展。
在临床糖蛋白质组学领域,已经鉴定出各种生物标志物或正在进行研究。人类唾液已被证明是临床诊断的宝贵资源。刘等人进行的研究涉及分析健康个体和NSCLC患者的唾液样本。这项研究发现NSCLC组中有154个N-糖位点和259个位点特异性糖型被调节。值得注意的是,一些N-糖位点位于相同的糖蛋白中,并且这些位点上附着的糖链表现出不同程度的表达。这尤其在糖蛋白如血红蛋白(Hp)、粘蛋白-5B、乳铁蛋白和α-1-酸性糖蛋白1中尤为明显,所有这些都与NSCLC密切相关。在SCLC中,岩藻糖基化过程特别普遍。Ahn等人鉴定了四种主要类型的岩藻糖基化蛋白质:血清淀粉样蛋白P成分、补体成分9(C9)、Kallistatin和对氧肟酶/羧酸酯酶1。这些糖蛋白显示出SCLC的重要诊断潜力。此外,由肿瘤细胞分泌的小细胞外囊泡(sEVs)携带大量有用信息,适用于不同亚型癌症的诊断。特定研究强调了来自SCLC和NSCLC细胞的sEVs上的N-糖基化模式,突出了糖蛋白在癌症诊断中的复杂性和潜力。243通过仔细比较标记蛋白的含量,研究发现肿瘤细胞来源的sEVs表现出不同的类型,每种都以不同水平的标记蛋白为特征。这一发现强调了sEVs之间的定性差异,特别强调了差异表达的63型簇分化(CD63)糖蛋白,它具有三个潜在的糖位点。具体来说,分析了不同sEVs中存在的核糖链的核心N-糖链结构。在来自三种NSCLC细胞的sEVs中,观察到双天线和三天线N-糖链的优势,以及核心岩藻糖基化的重要存在。这一发现与来自SCLC的sEVs形成鲜明对比,后者显示出N-糖链结构的巨大异质性,反映了SCLC细胞类型的多样性。此外,研究利用凝集素辅助探索了NSCLC sEV和SCLC sEV中的N-糖基化。一个显著的发现是两种sEV类型都表达了整合素αV。然而,一种特定的上皮特异性整合素,α6β4异二聚体,在NSCLC sEV中被独特地鉴定出来,其中它被NSCLC细胞中的N-糖链修饰。这种特异性为靶向癌症sEV中的N-糖蛋白开辟了道路,为检测和潜在的创新治疗策略提供了新的途径。
在医学研究中,不仅识别用于诊断的生物标志物至关重要,而且揭示药物抗性背后的复杂性也在制定有效的治疗策略和评估患者结果中发挥关键作用。与药物抗性相关的一个关键因素是蛋白质糖基化的异常改变。先前的研究揭示了NSCLC中膜蛋白的N-糖基化增加对顺铂的抗性,顺铂是一种常用的化疗药物。这项研究鉴定了297个膜糖蛋白,它们在A549细胞和其顺铂耐药对应物A549/DDP之间的表达存在差异,其中157个糖蛋白上调,主要与细胞粘附和药物反应相关,而140个下调,大多与细胞信号转导和迁移相关。此外,基于凝集素纳米探针的亲和质谱法被应用于探索与肺癌相关的异常糖蛋白。该方法被用来仔细检查从人肺腺癌细胞系PC9中用MNPs富集并与橙黄藻凝集素结合的糖蛋白。通过LC-MS/MS分析,一个值得注意的发现被揭示。与对吉非替尼敏感的PC9细胞系相比,PC9酪氨酸激酶抑制剂耐药变体(PC9-IR)表现出显著更高的岩藻糖基化水平。这在EGFR的糖位点N413的末端岩藻糖基化中尤为明显。这些修饰阻碍了表皮生长因子与其受体之间的正常相互作用,从而影响了受体形成二聚体的能力。这反过来影响细胞生长和对某些药物的反应,包括吉非替尼。
在肺癌的发展过程中,经常观察到异常的糖基化模式,表明开发有效的糖基化抑制剂可能有益。作为一种潜在的抑制剂,pictilisib利用网络药理学和体外筛选技术被测试,以评估Pictilisib处理的A549细胞中各种N-糖链的丰度,包括高甘露糖、未修饰、岩藻糖基化、唾液酸化和唾液岩藻糖基化糖链。这些结果表明,pictilisib处理显著降低了岩藻糖基化和唾液酸化N-糖链的整体相对丰度。值得注意的是,其中一些糖链涉及细胞凋亡、粘附和DNA损伤修复等过程。当用pictilisib处理时,诸如丙氨酸氨基肽酶、一种解整合素和金属蛋白酶10、整合素β-1和整合素α3等糖蛋白,在特定糖位点上的岩藻糖基化、唾液酸化和唾液岩藻糖基化水平降低。这些糖蛋白在与细胞粘附、凋亡、DNA损伤反应和细胞对化学刺激的反应相关的途径中富集。
总之,关于肺癌机制、诊断和治疗糖基化水平以及糖蛋白质组学进展的最新发现既令人惊讶又令人鼓舞。然而,诸如不充分的样本量和不一致的检查标准等各种因素阻碍了糖蛋白检测作为广泛认可的肺癌诊断实验室方法的接受。此外,准确识别肺癌亚型对于选择适当的治疗和预测患者预后至关重要,糖蛋白质组学可以在这一过程中发挥重要作用。理想情况下,糖蛋白的不同组分将允许对亚型进行精确验证,但当前数据仍不足以可靠诊断。必须承认,在揭示糖基化复杂性方面仍有许多工作要做,包括与肺癌相关的确切糖基化和生物学功能。这一领域的进展有潜力为肺癌患者带来显著益处。
3.3.2 结直肠癌
CRC是全球主要的健康挑战之一,影响结肠和/或直肠。它在全世界最常见的癌症中排名靠前,导致显著的发病率和死亡率。从历史上看,CRC主要影响中年和老年人群,特别是50岁及以上的个体。然而,最近的统计数据显示了一个令人担忧的趋势:年轻人群中心CRC的发病率增加。作为回应,医学界已将其武器库扩展到传统的手术、化疗和放疗之外。引入了免疫疗法和分子靶向疗法的创新,旨在改善治疗结果。这些先进的策略专注于修改肿瘤微环境(TME)或直接抑制癌细胞的增殖,从而提供更有效和高效的方法来对抗CRC。通过应用先进的定量糖蛋白质组技术,在CRC组织中鉴定了大量的N-糖蛋白。这包括发现九种显著上调的糖蛋白,与细胞信号转导、细胞粘附和细胞迁移等关键生物过程相关。在另一项研究中,又鉴定了160种表达上调的糖蛋白。其中,值得注意的例子包括细胞间粘附分子1(ICAM1)和脂肪细胞质膜相关蛋白(APMAP)。ICAM1在各种细胞功能中发挥关键作用,包括增殖、分化、死亡、凋亡和血管生成。此外,APMAP的存在与肝转移相关。这些发现强调了CRC中涉及的复杂分子机制,并突出了治疗干预和研究的潜在糖基化靶点。
3.3.3 肝癌
肝癌的死亡率在所有癌症中位居前列,主要原因是大多数患者在被诊断时已处于晚期,这通常会导致不理想的预后。大多数肝癌被归类为肝细胞癌(HCC)。这些癌的治疗通常涉及化疗和/或免疫疗法。近期的流行病学研究已经确定肥胖、肝炎、酒精消费、吸烟和糖尿病是LC的主要风险因素。这些因素促成了肝脏中炎症因子的激活和免疫系统的反应,包括异常糖基化蛋白的产生。
在中国,乙型肝炎病毒(HBV)感染是HCC的主要风险因素之一。对HCC组织和周围组织的详细分析表明,与邻近非肿瘤组织相比,肿瘤组织中岩藻糖基转移酶的调节异常,这与糖蛋白如IgA1和IgG中岩藻糖基化N-糖链的增加有关。
此外,对于与HBV相关的HCC中的Hp也报告了类似的发现,这突显了不同研究中一致的模式。在这项研究的基础上,Li等人通过检查HCC患者的尿液样本中的EVs取得了显著进展。他们的工作鉴定了344种在HCC患者中表达不同的独特N-糖肽,其中36种被下调,而惊人的308种上调。
其中,天冬酰胺连接的糖基化蛋白1同源物参与了N-糖基化的主要步骤。此外,研究还探讨了上皮-间充质转化(EMT)诱导因子,如TGF-β,对肝细胞纤维化和癌变的影响,揭示了这些过程的增加。用肝细胞生长因子处理导致两种类型的HCC细胞,SMMC-7721和HepG2,出现类似EMT的变化。在这些细胞中,几乎在叶酸受体α(FOLR1)的N69糖位点上鉴定了80种糖链,这突出了糖基化过程与癌症进展之间复杂的关系。进一步分析显示,在EMT过程中FOLR1的核心岩藻糖基化增加。对唯一的核心岩藻糖基化酶,岩藻糖基转移酶(FUT8)的评估表明,FUT8的含量与FOLR1的核心岩藻糖基化水平和叶酸摄取能力呈正相关,这可能为HCC的诊断和治疗提供新的生物标志物。
在HCC研究领域,不仅研究生物标志物至关重要,而且探索与HCC转移相关的糖生物标志物也非常重要。一项利用先进的定量分析技术检查非肝外转移与非转移样本中N-糖蛋白的研究揭示了11种糖蛋白在N-糖位点占据上的显著变化。这些糖蛋白,包括铜蓝蛋白(CP)、纤维连接蛋白-1和结合蛋白,发挥细胞粘附和迁移的关键作用。它们被鉴定为癌细胞转移的潜在生物标志物和预后不良的指标。282-284此外,p38 MAPK和NF-κB途径在肿瘤组织中持续存在。此外,溶质载体家族35成员A2(SLC35A2),它促进UDP半乳糖(Gal)从细胞质到高尔基体或ER的运输,并参与糖基化,在HCC组织中的增加与癌细胞的侵袭、粘附、转移和改变膜糖链轮廓的能力有关,这突显了糖生物标志物在HCC进展中的复杂相互作用。
总之,诊断和分类肝癌的主要方法主要依赖于AFP的测量和来自肝脏的一系列功能性酶。然而,这些生物标志物在诊断中的准确性仍然是一个令人关注的问题。因此,迫切需要识别新的生物标志物,以帮助临床诊断。此外,深入理解肝癌背后的机制将显著增强治疗策略,特别是在涉及各种糖蛋白的分子水平上。目前,治疗通常优先使用索拉非尼和/或mAbs,如nivolumab和pembrolizumab,作为一线药物。然而,这些治疗的有效性有些有限,一些患者对这些药物表现出明显的抗药性。因此,必须研究潜在靶标并开发能够有效抑制HCC增殖的创新药物。
3.3.4 胰腺癌
胰腺导管腺癌(PDAC)是全球最常见的胰腺癌之一,以快速进展和高死亡率为特征。在机制上,代谢重编程是PDAC的关键特征,伴随着复杂和异质性的肿瘤微环境(TME),为药物抗性奠定了基础。PDAC的风险因素包括家族史、感染、糖尿病、吸烟和肥胖。PDAC的诊断通常涉及临床评估、活检、影像学研究和肿瘤生物标志物的评估,包括糖抗原19-9(CA19-9)、糖抗原242(CA242)、糖抗原125(CA125)、癌胚抗原(CEA)和K-RAS基因突变。295 PDAC治疗的主要方法结合了系统化疗的手术。296,297 然而,对更准确和有效的诊断和治疗策略的追求导致了免疫疗法和分子靶向治疗的探索,以及各种糖蛋白的识别。CA19-9是一个有用的生物标志物,通常在大多数胰腺癌患者的血清中升高。这个生物标志物通过多种机制,如糖基化、与E选择素的相互作用、增强血管生成和参与免疫反应,发挥着加速胰腺癌进展的关键作用。CA19-9(唾液酸-Lewis a)的形成涉及逐步添加糖基团到前体的α1,4连接的岩藻糖上。这一特定过程由单一酶,岩藻糖基转移酶3(FUT3)促进,该酶负责通过α1,4连接添加基团,从而导致CA199的形成。然而,这种酶在小鼠中显著缺失,这为在这些模型中的研究带来了挑战。为了解决这一差距,进行了一项实验,以在小鼠中诱导人类FUT3和β1,3-半乳糖基转移酶5(β3GALT5)的表达,旨在在它们的系统中人工合成CA19-9。诱导后,表现出升高的CA19-9水平的小鼠最初经历了急性和慢性胰腺炎,这标志着炎症因子的增加。此外,观察到CA19-9水平的增加与胰腺癌进展机制的过度激活之间存在正相关。诚然,当依赖CA19-9水平时,诊断过程有时会受到假阳性或假阴性结果的阻碍。为了提高诊断精度,识别来自患者样本的额外生物标志物变得至关重要。一项利用MALDI-MS技术的研究调查了胰腺癌患者和具有阴性CA19-9结果的良性胰腺疾病患者的IgG血清半乳糖基化谱。发现胰腺癌组的IgG半乳糖基化水平显著高于对照组。此外,当与CA19-9水平一起评估时,诊断的准确性显著提高。这种方法强调了结合多个生物标志物以完善胰腺疾病诊断过程的潜力。分析和比较非转移性和转移性样本中的糖蛋白质组轮廓对于选择适当的治疗和预测患者预后至关重要。吴等人使用定量糖蛋白质组学报告称,胰腺癌患者的血浆样本中有22个糖肽上调,其中岩藻糖基化SERPINA1表现突出。他们的研究发现岩藻糖基化SERPINA1水平与胰腺癌的阶段和患者预后之间存在显著关系。具体来说,岩藻糖基化SERPINA1的高水平与增加的肿瘤结节转移阶段相关,并与较差的预后和总体生存率相关。这一发现突出了岩藻糖基化SERPINA1作为诊断胰腺癌的新生物标志物的潜力。整合蛋白质组学和N-糖蛋白质组学已成为评估胰腺癌药物疗效的有价值工具。
在一项研究中,两种胰腺癌细胞系PANC-1和BxPC-3用吉西他滨、阿司匹林或两者的组合处理。值得注意的是,阿司匹林的添加抑制了这些细胞系的活性。为了阐明这种效应的潜在机制,进行了完整的N-糖肽定量。这一分析揭示了阿司匹林和N-糖基化之间的显著协同作用。假设阿司匹林影响LAMP1/2的唾液酸化和高甘露糖修饰,从而抑制细胞自噬并增强吉西他滨的疗效。总之,N-糖蛋白质组学为理解与胰腺癌相关的治疗靶标和药物抗性机制提供了新的视角。
总之,糖蛋白质组技术的进步导致了众多糖蛋白靶标的识别,这对于阐明胰腺癌的机制和开发有效治疗至关重要。已经建立了异常糖基化与胰腺癌之间的显著相关性,某些生物标志物被识别为疾病进展的指标。然而,胰腺癌的异质性使得探索其糖蛋白质组景观变得复杂。此外,在MS过程中糖蛋白结构的丢失和降解进一步增加了结果的不确定性。因此,必须进行更深入的研究以理解与这种癌症相关的因果关系和功能,这些努力无疑将为临床治疗带来显著益处。糖蛋白质组学领域产生了重要发现,为深入理解癌症生物学提供了见解。例如,当前的研究集中在评估肿瘤细胞中的糖基化水平,识别蛋白质的异常糖基化,并了解相关酶的激活。目前,只有少数几个临床诊断生物标志物,包括AFP、PSA、ECA和CA19-9,获得了美国FDA的批准。许多糖蛋白标记物仍在研究中。然而,大多数现有标记物的准确性需要在未来的研究中进一步验证。因此,确切的诊断仍然依赖于活检和病理分析,这些是复杂且不易大规模实施的。因此,收集血清、尿液和唾液等样本进行糖链分析是一种更方便的方法。随着先进算法的整合,预计糖蛋白质组诊断方法的广泛应用将在未来成为现实。
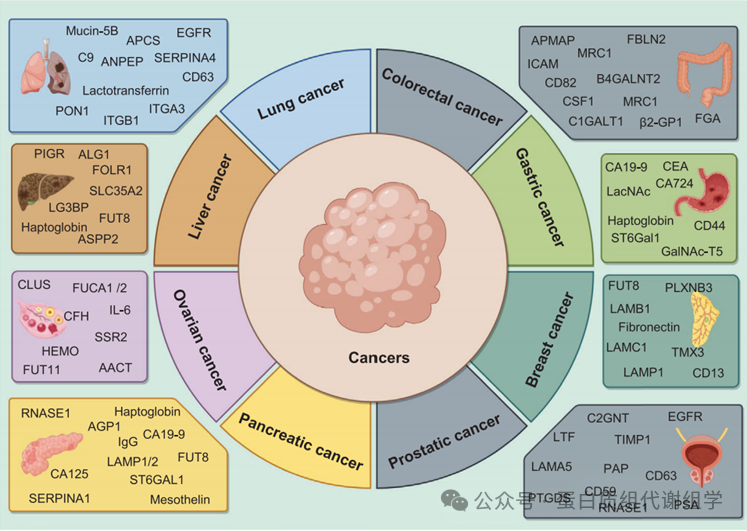
图5:糖蛋白组学技术建立的癌症相关生物标志物
- 上一篇:糖肽和糖蛋白分离富集方法精要必看 2024/11/9
- 下一篇:磷酸化蛋白/磷酸化肽段富集与分离方法研究最新进展 2024/11/9
