临床糖蛋白质组学研究方法综述
3 临床糖蛋白质组学与人类疾病
临床糖蛋白质组学方法的进步显著增强了其在广泛疾病中的应用。这包括脑部疾病、心血管疾病(CVDs)、癌症、肾脏疾病和代谢性疾病。这些创新为理解疾病机制、改进诊断和定制个性化治疗策略提供了有希望的途径。在此,我们旨在全面回顾和讨论糖蛋白在疾病机制中的作用,突出其在诊断和治疗干预中的重要性。通过这样做,我们希望为未来的临床糖蛋白质组学研究提供更清晰的方向,潜在地为疾病管理和治疗策略的突破性发现铺平道路。
3.1 脑部疾病
3.1.1 阿尔茨海默病
根据流行病学数据,到2050年,全球患阿尔茨海默病(AD)的风险人群预计将翻倍。AD的发展涉及三个主要阶段(图3)。最初,与微管相关的单元(Tau)蛋白在高尔基体内发生糖基化,导致它们在神经元中的积累。这一过程随后是淀粉样β斑块的产生和神经纤维缠结的形成。这些病理变化最终导致神经元丢失和退化,促成了与AD相关的认知障碍。淀粉样β蛋白的积累,主要由遗传变异如载脂蛋白E(APOE)引起,以及由Tau触发的神经纤维缠结的存在,代表了与AD相关的重大病理生理变化。近期的临床糖蛋白质组技术进展揭示了这些复杂的糖蛋白质组相互作用参与了AD的发病机制。例如,Zhang等人通过ZIC-HILIC和LC-MS/MS技术鉴定了与AD表型相关的六种N-糖蛋白。这些糖蛋白影响细胞外基质、突触和细胞器的功能,以及神经炎症、细胞粘附和内吞运输。同年,AD(APP/PS1转基因)小鼠大脑中的N-糖蛋白质组景观揭示了谷氨酸受体的失调,以及岩藻糖基化和寡糖基化糖链。Suttapitugsakul等人分析了正常、无症状和有症状AD人脑中的N-糖蛋白。他们的发现揭示了大脑主要含有高甘露糖、岩藻糖基化和双切N-糖链,通过多凝集素富集、HILIC和LC-MS/MS技术观察到不同AD阶段的独特表达模式。这些研究揭示了N-糖基化在AD发病机制中的多方面作用,为解释AD患者脑脊液中的循环糖蛋白及其潜在的诊断价值提供了宝贵的见解。此外,Losev等人对野生型人Tau的N-糖基化进行了深入研究。他们的分析揭示了N359和N410位置的天冬酰胺残基发生了N-糖基化。然而,当天冬酰胺被谷氨酰胺替代时,这种N-糖基化在突变体中是缺失的。此外,CSF中中间双切GlcNAc与Tau比率的患者被发现有更高的AD风险,风险比为2.06,95%置信区间(CI)为1.18-3.6。
同样,另一项研究发现32个N-糖位点被双切GlcNAc修饰。这种修饰由乙酰葡萄糖胺转移酶-III催化,涉及通过β-1,4-连接将GlcNAc转移到N-糖链的甘露糖上,这加剧了AD的发病。相比之下,二氢麦角克碱甲磺酸盐已被证明可以通过减轻异常的双切N-糖基化来缓解空间记忆障碍和阿尔茨海默病型变化。神经炎症被广泛认为是AD发病机制中的一个核心组成部分。因此,免疫糖蛋白可能作为精确检测AD的潜在生物标志物。例如,自然产生的自身抗体用于防御淀粉样β蛋白。最近的一项研究通过MALDI-TOF-MS分析了AD自身抗体的糖链结构。结果表明,N-糖基化在聚集、毒性和吞噬作用中发挥重要作用,预测疾病状态的特异性和敏感性分别可达100%和95%。同时,O-糖基化也影响AD的发病。以前的研究表明,淀粉样β蛋白,作为淀粉样前体蛋白(APP)的一个片段,是病理性老年斑块的重要成分。然而,切割位点的O-糖基化影响淀粉样蛋白的合成和产生,这无疑影响AD的进展。在2022年,开发了一个综合平台,结合了通用的水杨酸硼酸富集、高pH分级和EThcD方法,为AD患者和健康个体提供了O-糖基化的无偏轮廓。总共鉴定了308个O-糖肽,包括唾液酸化和非唾液酸化形式。此外,岩藻糖基化减少和内源性O-糖基化增加的趋势可能有助于AD的进展。此外,Shi等人开发了一种使用多片段技术的靶向MS方法来识别O-糖位点。在APP上鉴定了14个O-糖位点,其中至少有四个O-糖位点含有N-乙酰半乳糖胺(GalNAc)(Tn抗原)、核心1和单或双唾液酸化的核心。APP的超O-糖基化形式更容易降解成淀粉样β蛋白。在受AD影响的神经元中,低O-糖基化的APP被运输回高尔基体,在那里它获得额外的O-糖链。这种不典型的O-糖基化途径允许超O-糖基化的APP有助于淀粉样β蛋白的病理产生,表明其作为诊断和治疗靶点的潜力。Krüger等人144最初报告了一种通过分析CSF中的游离糖链来区分AD的方法。这些发现表明,当N-和O-糖链或单糖完全占据时,唾液酸化糖基化比O-糖基化更普遍。他们还展示了一些糖链能够有效区分AD患者和健康对照组。此外,鉴定了一类新的化合物,能够抑制去O-糖基化,显示出缓解AD症状的潜力。通过靶向OGlcNAcase(OGA),一种负责溶解O-糖链的关键酶,抑制了人类OGA和HexB的活性。这种抑制为开发有效的抗Tau磷酸化剂治疗AD提供了希望。
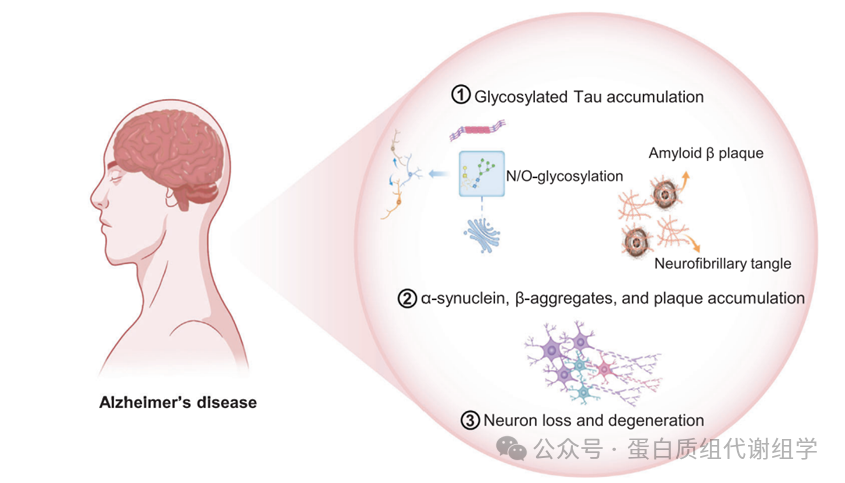
图3:阿尔兹海默病发病过程中的糖蛋白变化。
3.1.2 其他神经系统疾病
其他神经系统疾病,包括神经退行性疾病、神经精神疾病和神经发育疾病,受糖蛋白的影响程度不同。由于新型糖蛋白质组技术的发展,研究人员已经开始更深入地探索这些影响。像AD一样,帕金森病(PD)是一种受糖蛋白影响的神经退行性疾病;然而,支持这种关系的证据有限。最近的一项N-糖蛋白质组学研究揭示了与PD相关的蛋白质的总糖链水平和特定糖位点的核心岩藻糖、唾液酸和双切GlcNAc的增加。在神经精神疾病的背景下,已在精神分裂症患者的大脑中研究了γ-氨基丁酸受体(α1、β1和β2)的异常N-糖基化,表明N-糖基化的变化可能有助于非典型的神经情感。146最近的一项研究揭示了溶质载体家族39成员8(SLC39A8)基因中的错义变异与N-糖基化强烈相关。147纯合子功能丧失突变在SLC39A8中导致血浆锰(Mn)水平下降。重要的是,由于Mn在N-糖链生物合成中的关键作用,N-糖基化的分析显示前体N-糖链的增加以及复杂N-糖链的减少。此外,全基因组关联研究(GWASs)表明,参与O-糖基化的基因有助于精神分裂症的发病机制。例如,多肽N-乙酰半乳糖胺基转移酶10可以影响大脑中的糖基化酶,并已被确定与精神分裂症有强烈的联系。当糖基化与神经发育疾病相关时,相关发现显著较少。最近的一项研究揭示了X染色体连锁的神经配对素4(NLGN4)的异常N-糖基化与自闭症谱系障碍的发展相关。NLGN4中的突变破坏了相邻N102糖位点的N-糖基化,损害了表面运输和正常的突触功能。150雷特综合征,被认为是自闭症谱系障碍的一个子集,主要归因于甲基-CpG结合蛋白2(MECP2)基因的突变。特别是,在MECP2基因的突变中发现O-GlcNAcylation在苏氨酸203的缺陷会干扰培养细胞和鼠标模型皮层中的突触传递,导致各种功能障碍。事实上,越来越多的证据表明异常糖基化与脑部疾病之间存在联系。然而,特定糖基化模式与个别疾病之间的确切关系仍不清楚。影响思维、行为和发展的因素是复杂的,需要进一步调查。
3.2 心血管疾病
糖蛋白在心肌细胞和血管内皮细胞的形成和调节中起着基本作用,使它们能够执行生理功能、维持代谢和保持稳态。相反,异常的糖基化可能导致心血管疾病的发展。当前的研究主要集中在识别异常的糖基化过程和模式,旨在阐明异常糖基化与外部病理表现之间的内在联系,特别是在动脉粥样硬化(AS)、心力衰竭(HF)和缺血性心脏病(IHD)的背景下,将在下面详细讨论(图4)。最后,我们总结和讨论了心血管疾病糖蛋白质组学研究的进展以及现有的局限性。
3.2.1 动脉粥样硬化
AS的传统机制包括三个主要阶段:脂肪条纹的形成、粥瘤和动脉粥样硬化斑块的发展,这些都伴随着炎症(图4)。在血管内皮细胞的内膜空间中,氧化低密度脂蛋白(OxLDL)、巨噬细胞(特别是泡沫细胞)、平滑肌细胞(SMCs)和细胞碎片的积累,将导致血管腔狭窄,甚至血管闭塞和心肌梗死(MI)。目前,随着低密度脂蛋白(LDL)水平、吸烟率和血压的降低,风险因素的轮廓在一定程度上发生了变化,伴随着年轻AS患者的增加。这一新发现也将炎症途径与AS的进展联系起来。随着生物标志物检测技术的进步,人们不仅关注LDL,还关注免疫过程和细胞相互作用。通过清晰和系统地阐明AS的机制,精确的诊断和治疗在未来变得可行。糖链和糖链结合蛋白在疾病发展中起着至关重要的作用。内皮蛋白多糖和细胞结合的糖蛋白以及糖脂质是防止血浆成分与内皮细胞相互作用并破坏其完整性的屏障,同时也是GAG结合蛋白的库。此外,AS显著受到高脂血症的影响,特别是甘油三酯和胆固醇水平的升高,这与载脂蛋白和脂蛋白密切相关。161,162因此,这些蛋白质的糖基化可以影响AS的进展。值得注意的是,大多数与高密度脂蛋白(HDL)和LDL相关的蛋白质都经历了糖基化。在一项比较研究中,分析了因冠状动脉AS导致的心肌梗死患者与健康个体的血脂谱和糖基化脂蛋白,研究人员报告说,患者的血清中糖基化血红蛋白(G-HbA1c)、糖基化HDL(G-HDL)和糖基化LDL(G-LDL)的水平显著增加。此外,发现G-LDL的水平与血糖水平和HbA1c显著相关。如前所述,炎症对AS的进展至关重要。P选择素糖蛋白配体1(PSGL1)不仅作为一种跨膜糖蛋白,而且作为单核细胞上的一个重要的选择素配体。全基因组关联研究(GWASs)表明,多肽N-乙酰半乳糖胺基转移酶4(GALNT4)可能与AS的易感性相关。更重要的是,GALNT4的表达可以修改PSGL1的O-糖基化,随后激活下游信号分子,如Akt/mTOR和IκBα/NFκB,这增强了单核细胞的粘附和迁移。166这一糖基化过程在单核细胞的募集中起着至关重要的作用,以及在粘附分子和泡沫细胞膜蛋白的功能中,这些都有助于AS的进展。
最近的发现强调了各种糖蛋白在疾病进展中的关键作用。糖蛋白VI(GPVI)被认为是评估与AS早期阶段相关的凝血水平的重要标志物,例如血小板粘附。GPVI的存在量越高,表明血小板激活的可能性越大。这种相关性强调了GPVI在AS的早期检测和管理中的重要性。一项基础研究表明,通过给予抗GPVI抗体来抑制GPVI,可能会减慢或停止AS的进展。此外,关于从人类动脉粥样硬化斑块中提取的β2糖蛋白I(β2GPI)的有趣发现。这项研究揭示了斑块内的免疫反应,揭示了在富含β2GPI的区域中CD4(+)淋巴细胞的主要浸润,而CD8(+)淋巴细胞显著缺失。对β2GPI的不同淋巴细胞亚型的存在差异突出了免疫系统与动脉粥样硬化斑块发展之间的复杂相互作用。总之,OxLDL的形成和巨噬细胞的激活是AS发展的重要因素。糖基化在这一过程中广泛参与,影响糖蛋白的结构和功能,并导致病理变化。因此,阐明AS发展过程中糖基化模式的异常不仅增强了我们对潜在机制的理解,还为患者提供了潜在的新治疗靶点。
3.2.2 心力衰竭
心力衰竭已成为全球重要的流行病,其特点是高死亡率,尤其是在老年人口中。作为一种进展性疾病,心力衰竭主要涉及心肌损伤和心肌的异常收缩性。与心力衰竭相关的病理和生理变化可以归因于神经激素因素的变化,如β-肾上腺素激素、血管紧张素和内皮素,以及左心室心肌的重构。最近的临床研究表明,钠-葡萄糖共转运体2(SGLT2)抑制剂在治疗糖尿病时不仅降低了血糖水平,还减少了心血管疾病的发生率。研究已经证明SGLT2在调节酮体、碳水化合物和脂肪酸中起着关键作用,这对于心肌代谢至关重要,包括离子稳态和细胞氧化还原反应。此外,一些研究人员建议心力衰竭的发作可能与微量营养素的缺乏有关,这些微量营养素对于线粒体代谢至关重要,如铁、硒和锌。
Basigin(CD147),也称为细胞外基质金属蛋白酶(MMP)诱导剂,是一种跨膜糖蛋白,在MMP的合成中起着关键作用。这些酶在多种生化过程中是不可或缺的,包括心肌组织的重构。最近的一项研究发现,糖基化的CD147是心脏组织中的主要形式,并且在小鼠模型中对横向主动脉收缩(TAC)的反应中显著上调。此外,通过腺相关病毒9诱导心脏特异性过表达野生型CD147或带有三个改变糖位点的突变型CD147,揭示了重要的见解。接受野生型CD147注射的小鼠在TAC后心脏功能显著恶化,影响了心肌收缩和舒张。病理检查表明存在心肌肥大,特征是心肌细胞的横截面积增加和心肌纤维化,以及心房利钠肽和脑利钠肽等肥大标志物的水平升高。相比之下,表达特异性糖基化CD147的小鼠心脏功能得到改善,表明糖基化减轻了CD147过表达相关的有害效应。此外,CD147的基序分析呈现了与肿瘤坏死因子受体相关因子2(TRAF2)的潜在结合位点,以前与心脏功能障碍有关。免疫共沉淀研究表明,野生型CD147与TRAF2相互作用,而糖基化CD147与TRAF2的结合亲和力显著降低。因此,糖基化CD147为心力衰竭的治疗提供了新的视角。156在2022年,一种名为stachytine盐酸盐的药物被用来抑制N-糖基化中β1肾上腺素受体(β1AR)的α-1,6-岩藻糖基化,在小鼠研究中。β1AR的激活促进了其与G蛋白的结合,随后增强了环磷酸腺苷(cAMP)的合成。这一过程激活了蛋白激酶A(PKA)及其下游信号分子,最终导致心肌收缩力的增加。183LCA方法验证了stachytine盐酸盐通过降低α-1,6-岩藻糖基转移酶(FUT8)和α-1,3-岩藻糖基化蛋白4-β-N-乙酰葡萄糖胺转移酶A的活性,并增加β1AR上的N-糖基化,维持cAMP/PKA信号通路的激活以保护心肌细胞。184此外,MS被用来研究心力衰竭小鼠血清和组织中异常丰富的糖蛋白。发现小鼠能够合成N-乙酰神经氨酸(NeuAc)。然而,这种化合物主要存在于血清中,这与TAC的机制一致。
总的来说,心力衰竭中的糖蛋白质组学发现显著增强了我们对这种疾病机制的理解(图4)。重要的是,阐明关键糖蛋白的丰度和质量,以及建立心力衰竭患者和健康对照之间的标准化比较,对于有效的预防、诊断和治疗至关重要。当前的研究倾向于将异常糖基化的炎症因子与心力衰竭的机制联系起来。未来的研究应该探索抗炎策略和心肌细胞代谢的调节,以潜在地减缓甚至逆转心脏重构。
3.2.3 缺血性心脏病
全球缺血性心脏病(IHD)的发病率正在上升,导致心肌梗死的发生率增加,这与高死亡率有关,尤其是在女性中。研究人员认为,IHD背后的基本机制涉及动脉粥样硬化的动态过程或冠状动脉循环的改变,导致心脏血流减少,最终导致心肌氧气供应不足。在这个动态过程中,各种生物标志物,包括心肌肌钙蛋白、微小RNA和全身炎症指数,从细胞释放到血液中。这些生物标志物在预防和诊断IHD中起着重要作用。下面,我们详细讨论与IHD相关的某些糖蛋白生物标志物。一项多中心队列研究表明,载脂蛋白J(ApoJ)是一种细胞保护性和抗氧化糖蛋白,在心肌缺血期间显著诱导,并且糖基化ApoJ(ApoJ-Glyc)的水平降低。在经皮干预后,观察到ApoJ-Glyc水平的增加,表明ApoJ-Glyc可能作为早期诊断的新生物标志物。虽然全面讨论与IHD相关的改变很重要,但同样重要的是关注IHD的结果,如急性心肌梗死(AMI)和心肌缺血-再灌注(I/R)损伤。分析AMI中载脂蛋白A-I(Apo A-I)的特定N-糖基化和O-糖基化的研究揭示了45-kDa Apo A-I的变化与N-糖基化相关,而28-kDa Apo A-I的变化与O-糖基化相关。在心肌I/R损伤的过程中,心肌线粒体代谢相关糖蛋白发生变化。利用LC-MS/MS和生物信息学分析建立大鼠心肌I/R损伤模型的研究揭示了多种糖蛋白的变化,包括GalNAcα/β1-3/6 Gal、GalNAcα1,3 Gal和GalNAcα-1和3Galβ-1,与假手术组相比有显著差异。值得注意的是,被桑椹黑果凝集素(SNA)识别的Siaα2-6 Gal/GalNAc结构的数量显著增加。与AS和HF相关的发现相比,与IHD相关的糖蛋白质组学发现在临床诊断中仍然不足。一个原因是IHD通常与AMI同时诊断,这在很大程度上依赖于临床表现和心电图结果。然而,AMI的发生与高死亡率强烈相关。因此,识别与IHD相关的生物标志物并促进早期诊断和预防是降低AMI风险的关键步骤。总之,大量研究表明糖蛋白在调节心血管系统功能中起着关键作用,而异常糖基化可能导致心血管疾病。尽管我们强调了心血管疾病中糖基化的重要性,但必须认识到我们目前的理解仍然有限,特别是关于心血管疾病背后的详细机制。此外,从癌症和自身免疫疾病领域获得的见解中,当代研究倾向于关注与心血管疾病相关的炎症因子及其异常糖基化模式。鉴于心血管疾病中涉及的细胞类型多样,使用单细胞技术研究蛋白质糖基化可能会带来巨大的好处。最后,探索细胞相互作用对于深入理解心血管疾病的发生和进展至关重要。然而,当前的研究主要集中在阐明不同类型血管内皮细胞之间的变化,而不是系统地描述参与循环系统代谢的细胞之间的相互作用,并将这些相互作用与特定的病理生理变化联系起来。未来,糖蛋白质组学的进步预计将带来新的发现,这将显著增强心血管疾病的临床预防、诊断和治疗。
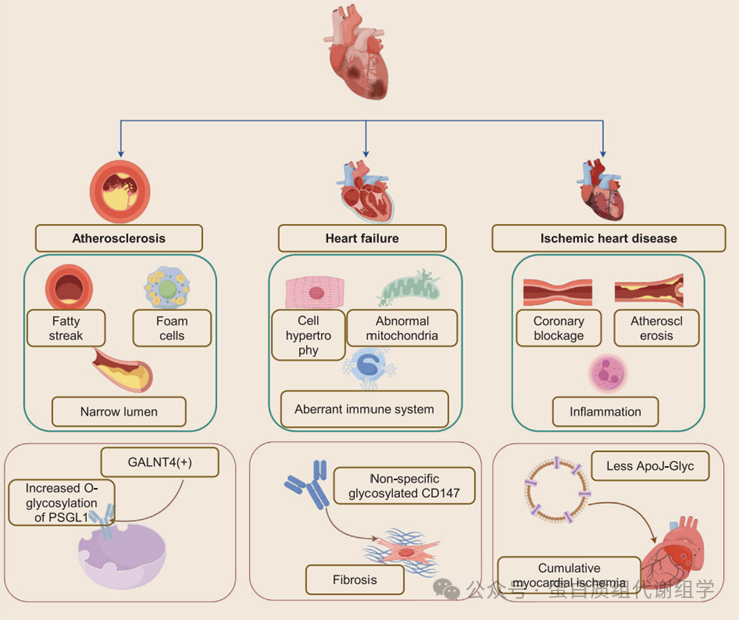
图4:心血管疾病的病理生理学与糖蛋白的异常变化
- 上一篇:糖肽和糖蛋白分离富集方法精要必看 2024/11/9
- 下一篇:磷酸化蛋白/磷酸化肽段富集与分离方法研究最新进展 2024/11/9
