视角:去中心化的纳米颗粒蛋白冠分析可能误导生物标志物的发现
Ali Akbar Ashkarran, Decentralized nanoparticle protein corona analysis may misconduct biomarker discovery, Nano Today, Volume 62, 2025, 102745,
ISSN 1748-0132, https://doi.org/10.1016/j.nantod.2025.102745.
摘要
蛋白质/生物分子蛋白冠 (PC) 是纳米颗粒 (NP) 暴露于血液或血清等生物体液后在纳米颗粒 (NP) 表面形成和进化的生物层。PC 的组成反映了生物环境,并受生物体疾病状态的影响。因此,PC 可以用作生物标志物库,其中疾病特异性蛋白质或蛋白质吸附模式的改变表明存在癌症、心血管疾病或感染等疾病。研究人员越来越多地利用 NPs-蛋白质相互作用来发现疾病的生物标志物,希望将 PC 用作病理状态的分子指纹,与传统方法相比具有独特的优势。NP 为蛋白质结合提供高表面积,充当通常难以检测的低丰度蛋白质的富集工具。此外,特定蛋白质与 NPs 表面之间的相互作用可以反映蛋白质构象或功能的改变,为疾病病理生理学提供进一步的见解。
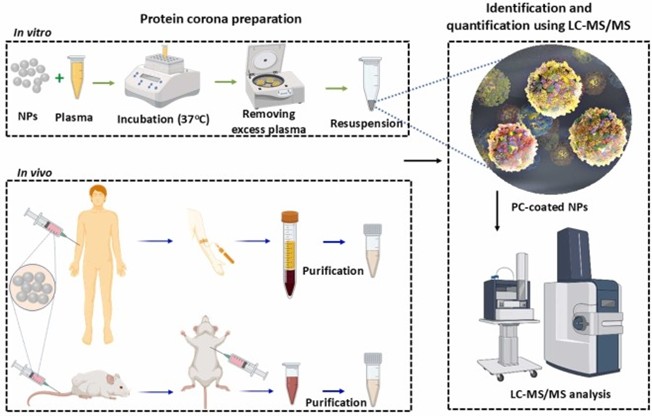
图 1.体外和体内暴露于生物体液中 PC 形成的示意图以及使用 LC-MS/MS 分析 PC 成分。
迄今为止,液相色谱-质谱联用 (LC-MS/MS) 仍然是表征 PC 和鉴定具有潜在诊断价值的此类蛋白质的主要方法。然而,质谱法在多大程度上促进了评估 PC 组成的技术变化,以及这些蛋白质组学结果如何影响纳米生物界面的解释,在很大程度上仍未得到探索。为了解决这一问题并强调我们工作的新颖性,我们在引言中添加了详细的讨论,强调了分散式蛋白质蛋白冠 (PC) 分析的独特方面,这在以前的文献中没有得到充分探讨。具体来说,我们的研究侧重于跨多个平台的分散工作流程带来的方法挑战,强调需要协调的协议来确保生物标志物发现的可重复性和可靠性。
据报道,从生物液体的处理和储存,到 NPs 制备,方法学上的不一致会引入显著的可变性,从而影响蛋白质组学结果的准确性。这些不一致会导致误解,最终阻碍纳米医学应用的临床转化。此外,物理化学性质(例如,大小、电荷、表面化学等)的表征不足严重影响了纳米生物界面数据的解释。在这里,我们讨论了这种可变性在分散的环境中进一步加剧,其中样品制备、仪器、数据收集和分析在多个实验室中进行,每个实验室都采用不同的协议。在影响纳米生物界面数据的各种参数中,这项工作专门为 PC 成分的分散分析如何影响生物标志物的发现提供了一个新的视角,并通过标准化方法提出了可行的解决方案。
随着 PC 分析的分散方法变得越来越普遍,这一研究领域面临着重大挑战,这些挑战可能导致在纳米医学领域(如生物标志物发现)得出误导性结论甚至不当行为。分散式 NP 的 PC 分析,即跨多个核心设施或平台进行分析和数据收集,存在数据多样性等缺点。事实上,这些平台在方法、样品制备和数据解释方面的不一致威胁着生物标志物鉴定工作的可重复性和有效性。在这种观点中,我们认为分散式 NP 的 PC 分析可能会引入可变性和偏差,导致不正确的生物标志物发现,从而可能损害基于纳米粒子的诊断技术的未来。
质谱分析是生物标志物发现的关键要素
MS 在生物标志物发现中起着至关重要的作用,因为它能够以高灵敏度和特异性识别、定量和表征各种生物分子,特别是检测低丰度蛋白质或肽。这在生物标志物发现中特别有用,因为生物体液中可能以非常少量的方式存在潜在的疾病标志物。此外,MS 可以与其他组学技术(例如基因组学、代谢组学)集成,以创建多组学数据集,通过将遗传变异与蛋白质表达和代谢途径联系起来来增强生物标志物的发现。MS 是生物标志物发现不可或缺的一些关键要素,包括但不限于蛋白质组范围的鉴定、蛋白质丰度的定量、翻译后修饰 (PTM)、生物标志物验证和多重检测能力。这对于生物标志物发现至关重要,用于检测可能以低浓度存在的疾病相关蛋白质,从而提供健康状态与患病状态下蛋白质表达的整体视图。此外,LC-MS/MS 可以对蛋白质丰度进行定量分析,从而深入了解蛋白质水平如何随特定疾病、治疗或环境因素而变化。此外,无标记定量或同量异位标记(例如,串联质量标签 (TMT) 或用于相对和绝对定量的同量异位标签 (iTRAQ)方法使研究人员能够比较多种条件下的蛋白质水平,这是识别用于诊断或预后应用的潜在生物标志物的关键。此外,LC-MS/MS 可以检测磷酸化、糖基化和泛素化等 PTM,这些通常在疾病过程中起着至关重要的作用。
最近的进展证明了 PC 分析在生物标志物发现和癌症诊断方面的变革潜力。Wang 等人开发了蛋白质钓鱼方法,将 NPs 的 PC 形成与机器学习相结合,以富集低丰度蛋白质并耗尽高丰度蛋白质,对早期非小细胞肺癌的诊断准确率达到 91.38%。同样,Xie 等人引入了一种血清蛋白变性策略来增强蛋白质组学深度,从而能够识别区分良恶性肺结节的关键生物标志物。虽然这些研究强调了开发创新工作流程以增强血清蛋白质组学的重要性,但重要的是要认识到 PC 分析中的分散工作流程,加上由于非标准化方案而导致的核心设施之间的差异,可能会引入不一致,从而破坏生物标志物发现的可靠性,并可能导致误解。
基于 MS 的生物标志物发现中的潜在陷阱
用于生物标志物发现的 NPs PC 分析面临重大挑战,部分原因是动态范围宽(即 22 种蛋白质占血浆蛋白重量的 99%),以及血浆中存在不同的蛋白质亚型。此外,从软 PC 到硬 PC 的转变涉及竞争性吸附,并受几个关键参数的影响,包括蛋白质浓度、结合亲和力和 NP 的物理化学性质。在这方面,由于 NPs 表面 PC 形成的动态性质,NPs 的PC 具有富集人血浆蛋白质组的潜力。在生物标志物发现中,PC 的关键方面之一是低丰度生物标志物的富集,这些生物标志物以非常低的浓度存在于人血浆中,并且可以在 PC 层中富集。这种富集有助于检测和鉴定可能难以直接从复杂生物基质中检测的稀有生物标志物。除了 NP 的物理化学性质外,生物液体中存在的代谢物、脂质、维生素和其他类型的小生物分子还可以与这些液体中的蛋白质相互作用并影响它们的行为,包括它们对 NP 的吸附并产生独特的 PC 模式。最近报道,高水平的胆固醇作为涉及各种人类疾病(例如心血管疾病)的重要代谢物,由于在胆固醇存在下蛋白质与 NPs 的结合亲和力发生变化,导致 PC 富含载脂蛋白和减少补体蛋白。在解决 NPs 的PC 的复杂性时,我们之前证明,调节 PC 组成可显着提高血浆蛋白质组的检测深度,从而能够捕获具有高诊断价值的稀有和低丰度蛋白质。
在这方面,NP的 PC 等新兴技术对于降低生物标志物发现中给定生物流体的生物复杂性至关重要。然而,鉴定稳定且可重现的 PC 组成和/或蛋白质生物标志物在很大程度上取决于 MS 工作流程。例如,最近的研究结果表明,当使用不同的方法、方案、LC-MS/MS 仪器和原始数据处理时,相同的 NP的 PC 结果在不同的蛋白质组学中心中表现出显著的异质性,并且无法在独立研究中轻松比较 PC 结果。当生物标志物结果的可重复性是一个持续的挑战时,这是临床领域的一个关键问题。换句话说,在一项 PC 研究中发现的蛋白质/生物标志物在后续调查中或应用于不同的患者群体时不一定有效。因此,迫切需要开发一种独特的 PC 分析集中式标准方案,以最大限度地减少最终可用于临床应用的 PC 结果的异质性。Zhang 等人最近发表的方案概述了在生物和环境背景下对 NP 进行 PC 分析的综合框架。虽然研究的重点是为不同系统的 PC 分析开发通用工作流程,但我们的研究强调了分散式工作流程对使用 LC-MS/MS 进行 PC 表征的影响,以及这些复杂性如何误导生物标志物的发现。我们专门解决了由非标准化方案引起的核心设施和蛋白质组学中心之间的变异性问题,这一挑战迄今为止尚未得到充分承认。
这里的主要重点是解决与分析 NP 的硬 PC 相关的挑战。虽然 LC-MS/MS 是一种强大的技术,可为硬 PC 分析提供高灵敏度和特异性,但当应用于 NP 的软 PC 时,它存在明显的局限性。质谱分析所需的净化过程通常会破坏 NP 的微妙平衡,导致形成软 PC 的松散结合蛋白质丢失。这损害了准确区分软 PC 层和硬 PC 层的能力。尽管已经开发了先进的技术,如场流分离、基于原位生物膜干涉测量法 (BLI) 的捕捞策略、多参数表面等离子体共振 (MP-SPR Navi™ LayerSolver™) 和荧光相关光谱 (FCS),用于原位研究软 PC 的形成,但这些方法通常难以有效地将软 PC 与硬 PC 隔离或缓解污染和动态等问题变异性。此外,离心是分离 PC 包被的 NP 的最广泛使用的方法,在这方面尤其有限,因为它主要分离硬 PC,而由松散连接的蛋白质组成的软 PC 通常会在此过程中丢失。因此,分离和研究软 PC 仍然是一项重大挑战,需要创新的实验方法来解决其脆弱性以及下游 LC-MS/MS 分析带来的额外复杂性。
不当行为的来源
使用 MS 进行 PC 分析和生物标志物发现的整个程序包括三个核心阶段,包括样品制备、使用 LC-MS/MS 系统进行测量和数据分析。第一阶段的样品制备有几个核心步骤,例如蛋白质浓度测量、变性、还原、烷基化、蛋白质消化和脱盐/清洁,乍一看似乎相对简单,如图2所示。然而,这可能只是冰山一角,这些步骤中的每一个都有其他几个多步骤,其中包含许多实验和技术细节,这些细节可能因核心设施而异(在图2中示意性地显示为冰山深度),并且在 PC 分析过程中需要仔细考虑以发现生物标志物。例如,最近表明,在 NP 的 PC 分析期间,各个蛋白质组学中心在样品制备、仪器、定量方法、搜索参数以及原始数据处理和报告方面存在许多差异,这导致最终相同 NP 的 PC 结果存在显着差异(即,美国 17 个蛋白质组学中心之间只有 1.8% 的共享蛋白质)这些变化从最初的蛋白质消化步骤开始,一直持续到分析的最新步骤(例如,原始数据处理),一旦积累,最终会导致最终结果的复杂分歧和数据不一致,如下所示
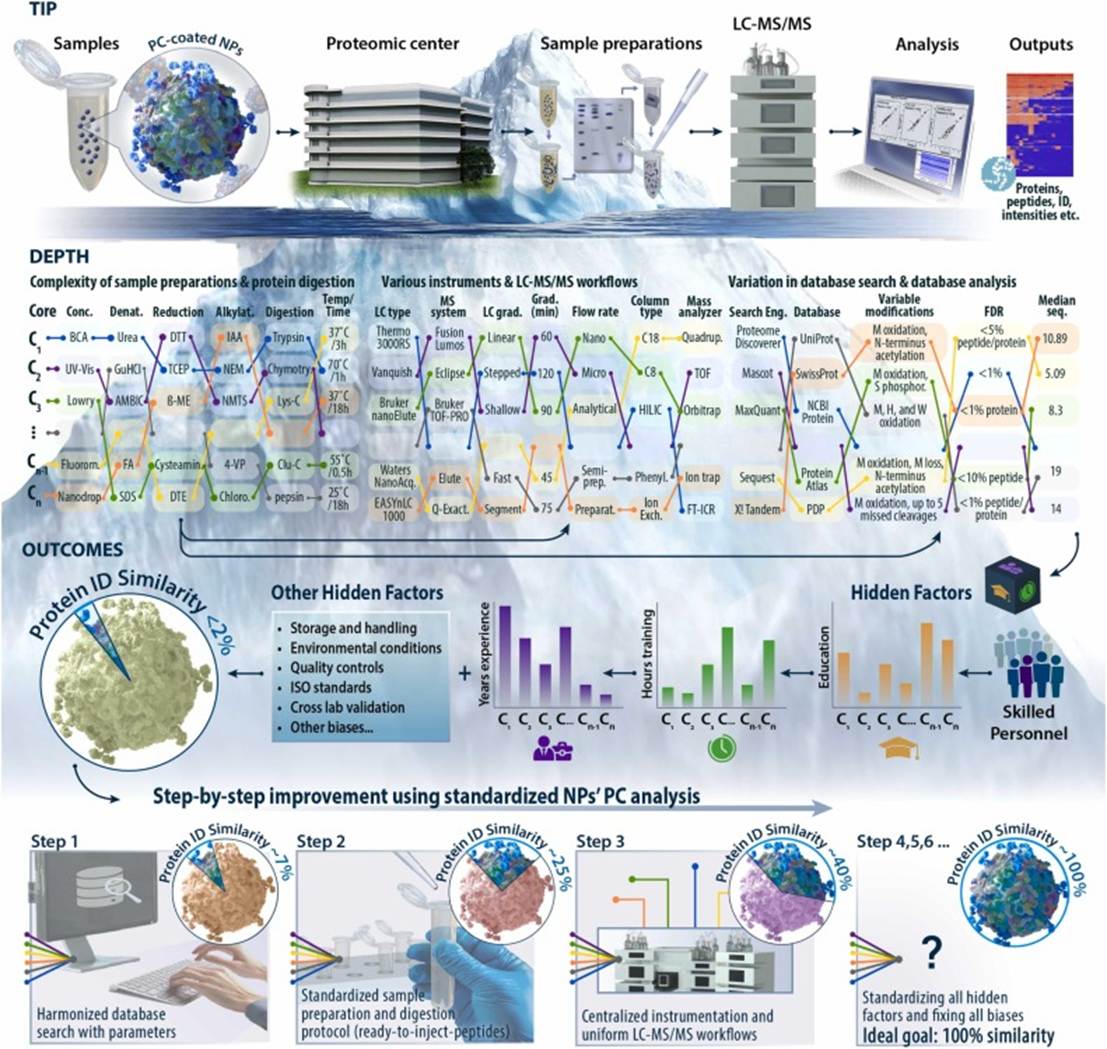
图 2.使用质谱法对看似简单的 NP PC 分析背后的复杂性的示意图。
该图强调,虽然分析 NP 的 PC 组成的工作流程可能看起来很简单,但它只是“冰山一角”。表面之下隐藏着显著的复杂性,包括不同的样品制备方法、LC-MS/MS工作流程的变化(例如,仪器、色谱和质量分析仪)以及数据库搜索参数(例如,PTM和错误发现率(FDR))。这些因素在蛋白质鉴定中引入了巨大的可变性,可能会影响关键的纳米医学应用,例如生物标志物发现,在这些应用中,研究的一致性和可重复性至关重要。(缩写:二辛可宁酸 (BCA)、紫外可见光谱 (UV-Vis)、荧光 (Fluorom)、二硫苏糖醇 (DTT)、三(2-羧乙基)膦 (TCEP)、β-巯基乙醇 (β-ME)、盐酸胍 (GuHCl)、碳酸氢铵 (AMBIC)、甲酸 (FA)、十二烷基硫酸钠 (SDS)、二硫苏糖醇 (DTT);碘乙酰胺 (IAA);N-乙基马来酰亚胺 (NEM)、氯乙酰胺 (chloro);N-甲基硫代苯磺酰胺 (NMTS);胰凝乳蛋白酶 (Chymotry), Glu-C (V8 蛋白酶) (Glu-C), 半制备流式 (semi-prep);制备液程 (preparat))。
样品制备
使用 LC-MS/MS 进行 NP PC 分析时,样品制备和蛋白质消化成肽是关键步骤。两种广泛使用的酶解技术是磁珠上酶解和凝胶内酶解,根据样品类型、复杂性和所需结果,每种技术都具有独特的优势和局限性。例如,一些蛋白质组学中心从磁珠开始,而一些蛋白质组学中心使用凝胶内消化方法,这两种起始方法在多大程度上影响了最终结果的差异,在很大程度上仍然未知。使用聚丙烯酰胺凝胶对不同的、分子量分离的蛋白质条带进行测序,增强了分析蛋白质混合物的动态范围,并允许在较宽的丰度范围内检测蛋白质,因为每个条带的凝胶内胰蛋白酶消化产生的肽都是单独测序。例如,将蛋白质组分布在 10-20 个凝胶切片中可显著提高分析深度,从而鉴定出更多蛋白质并检测适合分析复杂混合物的 PTM。此外,凝胶电泳可有效去除低分子量污染物,例如去污剂和缓冲液组分,这些污染物会阻碍质谱测序 。
另一方面,在磁珠上消化中,蛋白质与磁珠(例如磁珠或琼脂糖磁珠)结合,并直接在磁珠表面消化,无需事先洗脱。磁珠上消化具有更快的制备过程(即蛋白质直接在磁珠上消化)、更简单的工作流程、减少样品损失并提高通量的优势。此外,磁珠上消化可有效捕获低丰度蛋白质,尤其是在亲和纯化实验中,其中目标蛋白质已经富集。然而,磁珠上消化方案的蛋白质覆盖率较低,这些蛋白质难以溶解或在与磁珠结合时受到空间位阻,这可能导致消化不完全。此外,磁珠上消化对于靶向蛋白质研究更有效、更直接,尤其是在亲和纯化设置中,而凝胶内消化提供更好的蛋白质分辨率,可用于分析复杂样品。
Table 1. Comparison of on-bead and in-gel digestion methods for proteomic analysis of PC-coated NPs.
| Feature | On-bead digestion | In-gel digestion |
|---|---|---|
| Sample preparation | Fast and simple; fewer steps | Labor-intensive; requires electrophoresis and excision |
| Protein identification | Lower protein coverage in complex mixtures | Higher coverage with separation of complex samples |
| Protein separation | No separation; relies on affinity enrichment | SDS-PAGE-based size separation |
| Peptide recovery | High recovery, minimal sample loss | Lower recovery due to extraction losses |
| PTMs | Suitable for PTMs, especially with affinity purification | Useful for isoforms and PTMs after gel separation |
| MS compatibility | High compatibility, fewer contaminants | Requires optimization; risk of gel contaminants |
| Applications | Affinity pull-downs, low-abundance proteins | Complex proteomes, differential expression studies |
此外,许多蛋白质组学中心使用二硫苏糖醇 (DTT) 或 β-巯基乙醇 (β-ME) 在变性后破坏蛋白质内的二硫键,这有助于防止蛋白质聚集并保持蛋白质处于变性状态。然而,一些蛋白质组学中心跳过了这些关键的制备步骤和/或对 DTT 和 β-ME 分别使用 1 mM 至 10 mM 和 1–10 % 的不同浓度。IAA(典型浓度为 5 mM 至 50 mM)是最常见的烷化剂之一,可与游离半胱氨酸残基反应,从而防止样品制备过程中二硫键的重组。一些核心设施也可能单独或组合使用三氟乙酸 (TFA) 和 FA,具体取决于实验的具体要求和被分析蛋白质的性质。与此同时,许多用于 NP PC 分析的可用方案可能会忽略这些步骤,而只是从胰蛋白酶消化开始几个小时来消化蛋白质。
胰蛋白酶处理是样品制备中的关键步骤之一,在确定 LC-MS/MS 中蛋白质鉴定的效率和结果方面起着至关重要的作用。优化胰蛋白酶处理条件对于提高 LC-MS/MS 中蛋白质鉴定的水平至关重要,因为它会影响酶解效率、肽产量和 PTM 保存。关键因素包括酶与底物的比例、消化时间、温度、pH 值和添加剂。例如,高酶蛋白比值和长时间消化会增加切割,但可能导致过度消化和非特异性肽,而低比例或短消化时间则存在不完全切割的风险。而不同的蛋白质组学中心使用各种类型的胰蛋白酶和广泛的温度和孵育时间进行蛋白质消化,这可能会影响蛋白质切割。酶特异性、活性和切割效率的这种变化会显著影响生成的肽的数量和类型。例如,据报道,牛胰蛋白酶产生更多缺失切割的肽,而猪胰蛋白酶产生更多的半胰蛋白酶肽。此外,在几个切割位点观察到消化动力学的差异,这从 2 小时和 18 小时消化之间肽丰度的变化中可以看出。
此外,清洁和脱盐条件还通过去除污染物、盐和其他干扰物质来显著影响蛋白质鉴定,这些物质会抑制电离、降低灵敏度和模糊肽信号。LC-MS/MS 样品制备中节省成本的清洁方法,例如减少脱盐步骤、重复使用低质量固相萃取 (SPE) 色谱柱、沉淀后进行最少的清洗或使用不正确的透析膜,可能会对蛋白质鉴定产生负面影响。例如,Thermo Fisher Scientific 的一项研究比较了四种 MS 样品制备方法:Pierce 试剂盒、过滤辅助样品制备 (FASP)、AMBIC/SDS 和尿素萃取,发现 Pierce 试剂盒方案(包括 C18 脱盐步骤)可鉴定出最多的独特肽和蛋白质,以及最低的漏缺切割百分比。例如,与磁珠上或凝胶内消化等传统方法不同,FASP 使用基于过滤的方法将样品净化和酶消化相结合。FASP 对于处理复杂的生物样品(如血清、血浆或细胞裂解物)特别有效,可提高肽回收率并最大限度地减少污染。它简化了工作流程,提高了可重复性,并能够高效处理难以溶解的蛋白质。与磁珠上和凝胶内消化方法相比,FASP 提供了一种简化、无污染的方法,非常适合高通量研究,使其成为现代蛋白质组学中的关键工具。然而,由于离心步骤多,它可能非常耗时,并且可能需要优化以防止低丰度蛋白质的损失。因此,适当平衡的脱盐方法可以确保高肽回收率、最低污染和最佳信号质量,这对于在 LC-MS/MS 中准确且可重现地鉴定蛋白质至关重要。
仪器
样品制备后,LC 和 MS 仪器的选择以及相应的工作流程是第二个关键步骤,在确定蛋白质鉴定的深度和准确性方面起着至关重要的作用。关键因素包括色谱柱类型和粒径,其中高分辨率色谱柱可增强分离效果,但会增加运行时间和分析成本,而标准色谱柱可能有助于鉴定高丰度蛋白质。此外,色谱规模起着至关重要的作用,纳质谱相色谱对低丰度蛋白质的灵敏度更高,而标准液相色谱更稳定,但灵敏度较低。此外,较长的梯度可改善复杂蛋白质的分离,但较短的梯度会耗费时间,并且较短的梯度可能会引入共洗脱,因此更适合丰度肽。此外,多维液相色谱(如 2D-LC 或分级分离)提高了蛋白质组覆盖率,但需要大量的设置,而单维液相色谱速度更快,但不太全面。除了影响灵敏度和回收率的样品上样和进样方法(例如,直接进样与捕集洗脱法)外,流动相组成的其他几个参数(例如缓冲液选择和 pH 控制)也可能影响肽保留。
液相色谱分离后,质谱仪首先测量完整肽(母离子)的质荷比 (m/z)。然后,选定的肽通过碰撞诱导解离 (CID)、高能碰撞解离 (HCD) 或电子转移解离 (ETD) 等技术进行碎裂,将母离子分解成更小的碎离子以进行详细分析。每种碎裂方法都会影响可检测、鉴定和定量的肽的范围和类型,从而对生物标志物的发现产生独特的影响。不同的质量分析器(例如 orbitrap、Time of Flight (TOF) 或离子阱)的分辨率和灵敏度不同,影响了低丰度蛋白质的检测,而低丰度蛋白质通常是关键的生物标志物。例如,高分辨率质量分析器(例如 orbitrap)可提供低丰度肽的精确鉴定和详细的 PTM 表征;它可能适用于复杂样品中丰度较高的蛋白质。虽然低分辨率质量分析仪(例如离子阱)更实惠、更快速,但分辨率可能有限,这反过来会阻碍密切相关的肽和低丰度蛋白质的检测,从而可能偏倚生物标志物的发现。因此,在复杂样品(如 PC 包被的 NP)中,选择正确的碎裂技术或结合多种方法可以减少这种偏差,有助于确保更全面、更准确的生物标志物谱。
数据分析
最后一个阶段会显著促进蛋白质和肽的鉴定,并在生物标志物发现中产生偏差,即用于 LC-MS/MS 原始数据处理和分析的方法和途径。这些关键步骤包括但不限于数据预处理算法、识别阈值和数据库搜索、定量方法(例如,无标记和标记定量)、归一化和缩放技术、统计分析和显著性阈值、生物信息学和通路分析工具。例如,用于降噪、峰拾取和对齐的数据预处理方法会影响保留或丢弃哪些信号,从而在原始 LC-MS/MS 数据分析过程中产生蛋白质鉴定偏差。灵敏度较低或过于激进的预处理可能会消除低强度信号,并可能影响低丰度肽的检测,这些肽通常是关键的生物标志物。严格的筛选标准和参考数据库的选择(例如 Uniport 和 Proteome Discoverer)会影响蛋白质鉴定。最近表明,实施标准化数据库搜索提高了可重复性,将不同设施之间的一致蛋白质鉴定从 1.8% 提高到 35.3%,并强调了标准集中式方案在 NP 的 PC 分析中用于纳米医学应用的重要性。
过于严格的阈值可能会遗漏低置信度的肽段,而不太严格的设置可能会导致假阳性。此外,数据库的限制可能导致对特征明确的蛋白质的偏见,可能会忽略新的生物标志物。由于电离效率和重现性的可变性,无标记定量可能偏向于高丰度蛋白质,而标记方法(例如,TMT 或细胞培养中氨基酸的稳定同位素标记 (SILAC))提供了更好的相对定量,但成本高昂且多重检测能力有限。定量方法的选择会影响低丰度生物标志物的检测和差异表达分析的准确性。此外,用于归一化和缩放数据的方法(例如,总离子电流和中位归一化)会影响相对丰度计算,这可能会偏向于某些蛋白质/肽或样品类型,从而使生物标志物的发现产生偏差。换句话说,不适当的标准化可能会放大技术差异或掩盖生物学相关的变化。此外,统计阈值和分析方法用于确定蛋白质水平的显着变化会影响哪些蛋白质/肽被标记为潜在的生物标志物。事实上,过于传统的阈值可能会错过微小但重要的生物变化,而灵活的设置可能会导致假阳性和不准确的生物标志物谱。此外,用于解释数据的生物信息学工具在生物标志物选择中起着至关重要的作用。一些工具是针对特定的蛋白质家族或通路量身定制的,这可能导致偏向于某些生物过程,可能会忽略可能作为潜在诊断生物标志物的不太明确的蛋白质。
展望 – 我们如何弥合 NPs PC 分析的差距?
为了解决在纳米生物界面进行 LC-MS/MS 分析过程中 NP PC 结果的不一致性和不可重复性,我们提出了三项关键行动,包括:(i) 标准化样品制备和蛋白质消化方案,(ii) 协调 LC-MS/MS 仪器和工作流程,以及 (iii) 实施统一的数据处理。使用标准作方案,尤其是在各种消化步骤中,对于可靠和可重复的 NP 的 PC 结果至关重要。通过统一蛋白质浓度测量技术(例如,仅 BCA 方法)、一致的方案步骤(包括预酶解还原和烷基化)、使用一致的添加剂(即化学品/材料)(如变性剂和还原剂)、酶(例如胰蛋白酶)和酶蛋白比(例如,1:50)、酶解时间(例如,18 小时)、温度(37 °C)等,实验室可以最大限度地减少肽回收和蛋白质鉴定的差异。这种标准化使得在独立研究中轻松比较 PC 结果,并提高蛋白质定量和生物标志物发现工作的准确性。
在标准化 LC-MS/MS 仪器中,建议使用类似类型的 LC 和 MS 仪器,以减少分析之间的不一致。同步 LC-MS/MS 仪器和设置(如质量分辨率、电离模式、碎裂方法等)也很重要,以确保研究之间的重现性,这对于更广泛的纳米医学应用至关重要。在系统式 LC-MS/MS 仪器中,应统一设置不同仪器的质量分辨率(例如,在 Orbitrap 系统上为 60,000 或更高),并且电离模式也应保持一致(例如,肽分析为阳性,磷蛋白为阴性)。应根据样品类型选择碎裂方法(即 HCD 或 CID)(例如,用于肽鉴定的 HCD 具有 30–35% 的归一化碰撞能量)。此外,校准程序和内标(例如用浓度为 50 fmol/μL 的重标记肽加标样品)有助于对齐仪器响应,确保整个实验中的准确定量。
在用于 NP PC 分析的统一原始 LC-MS/MS 数据处理中,关键考虑因素可能包括标准化峰拾取、降噪和对齐算法,以确保在相同样品中对肽的一致检测。应用统一的 FDR 阈值(例如 1 %)进行蛋白质鉴定可减少假阳性,而一致的归一化和定量方法可确保蛋白质丰度的可比性。此外,使用标准数据库(例如,Maxquant 或蛋白质组发现器)和统一的搜索参数,例如可变修饰(例如,M 氧化、蛋白质 N 末端的乙酰化、天冬酰胺的脱酰胺、脲甲基化等)和允许的漏缺切割(例如,最多 2 个)在很大程度上最大限度地减少了最终结果的可变性。这些步骤相结合提高了可重复性,减少了偏倚,并增强了 NP PC 研究中生物标志物发现的可靠性。
由于 NP 表面的蛋白质持续吸附和解吸,捕获 PC 组成的动态变化仍然是一项重大挑战。虽然目前的检测方法(如 LC-MS/MS)仅提供蛋白冠的静态快照,但研究人员一直在探索实时监测技术,以更好地了解 PC 在 NP 表面上的动态形成。通过散射显微镜进行实时光学纳米颗粒分析 (RONAS) 和表面等离子体共振显微镜 (SPRM) 等方法能够对蛋白质吸附和解吸进行动力学跟踪。此外,片上电气监控技术可实时对软硬 PC 进行无标记观察。此外,场流分离 (FFF) 已成为 PC 原位分析的宝贵工具。FFF 允许温和分离 NPs 及其相关的 PC,而不会破坏所涉及的复杂平衡。这些进步为蛋白冠动力学提供了有价值的见解,对纳米医学应用和生物标志物发现具有重要意义。另一方面,将人工智能 (AI) 整合到 PC 分析中,在克服单一检测方法的局限性方面具有巨大潜力。机器学习模型可以通过预测 PC 形成、跟踪动态变化和提高 PC 成分分析的准确性来增强实时监控。来自质谱、SPR 和散射显微镜等多种技术的 AI 驱动数据集成可以更全面地了解 PC 动力学。然而,挑战仍然存在,包括需要高质量的训练数据集、分析方法的标准化以及在复杂生物环境中验证 AI 预测。
总之,虽然质谱法对于在 NP 的 PC 研究中鉴定疾病特异性蛋白质非常有价值,但必须仔细注意方法学陷阱,因为它可能会引入方法学不一致的重大风险,从而导致生物标志物发现中的错误行为。通过标准化方案、仪器和严格的数据处理来应对这些挑战,将提高基于 MS 的 PC 分析的可靠性,并在生物标志物发现研究中提供更准确和可重现的结果。厦门普睿迈格生物科技有限公司提供低丰度蛋白富集磁珠http://www.purimagbead.com/Product/8096211554.html
- 上一篇:SP3 和 SP4 捕获蛋白质的差异展现了蛋白质组学纯化技术 2025/4/15
- 下一篇:下一代纳米颗粒蛋白冠表征方法展望 2025/4/5
