Mann神出手警惕血浆蛋白组学数据中可能的污染!!血浆蛋白组学新标准?
在蛋白质组学研究领域,血液样本作为蕴含丰富疾病信息的微创样本为疾病标志物的发现提供了宝贵的资源。然而,血浆样本处理过程中的污染问题始终是悬在研究者头顶的“达摩克利斯之剑”。近日,德国马普所的蛋白组学大神Matthias Mann,和他的知名高足Phillipp Geyer在bioarxiv上发表一篇题为“Pre-Analytical Drivers of Bias in Bead-Enriched Plasma Proteomics”的研究结果,剑指在质谱血浆蛋白组学领域一直存在的蛋白鉴定数据质量良莠不齐、缺乏标准,甚至人为数据造假的乱象。


Matthias Mann大家都很熟悉了,是当今国际蛋白组学的擎旗人。Philipp Geyer是人类血浆蛋白组计划(HPPP)的主要负责人,也是Ions Lab的创始人,一直致力于将蛋白组学推向精准医学产业化。其实,早在血浆蛋白质组解决方案推出之初便根据Matthias Mann团队发表于《Embo Molecular Medicine》(IF=9.0)的血浆样本红细胞、血小板、凝血污染质控建议设计了“血浆质量影响因素评估”模块,协助广大研究者进行污染样本剔除。

1. 纳米颗粒表面蛋白冠——检测深度与污染敏感性的平衡
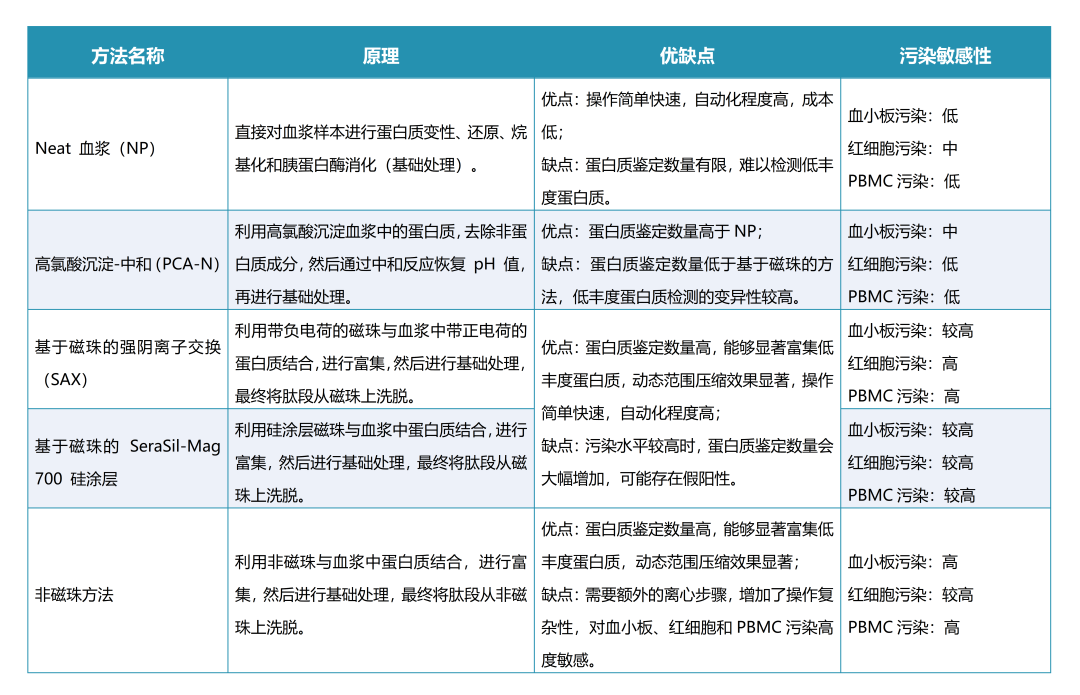
血浆蛋白质丰度范围广泛,其中22种高丰度蛋白含量占比超过总蛋白含量99%,低丰度蛋白占比少于1%,却在疾病早期诊断、预后治疗、生物标志物研究方面具有重要价值。为提升血浆蛋白质组队低丰度蛋白的覆盖度,业内专家陆续提出了多种前处理方案。Philipp Emmanuel Geyer/Matthias Mann团队的最新研究基于常见的五种血浆蛋白质组前处理方法,通过在纯净血浆样本中添加指定数量的血小板、红细胞、外周血单个核细胞(PBMC),比较各前处理方法对细胞污染的抵抗性。研究发现富集技术虽能显著提升低丰度蛋白的检测深度,但对细胞污染高度敏感。相比之下,PCA-N流程对细胞污染表现出较强抵抗力。

这个研究的核心精髓体现在下面一张数据图,能给血浆蛋白组学的健康良性发展正本清源,笔者觉得有必要拿出来详细讲解。
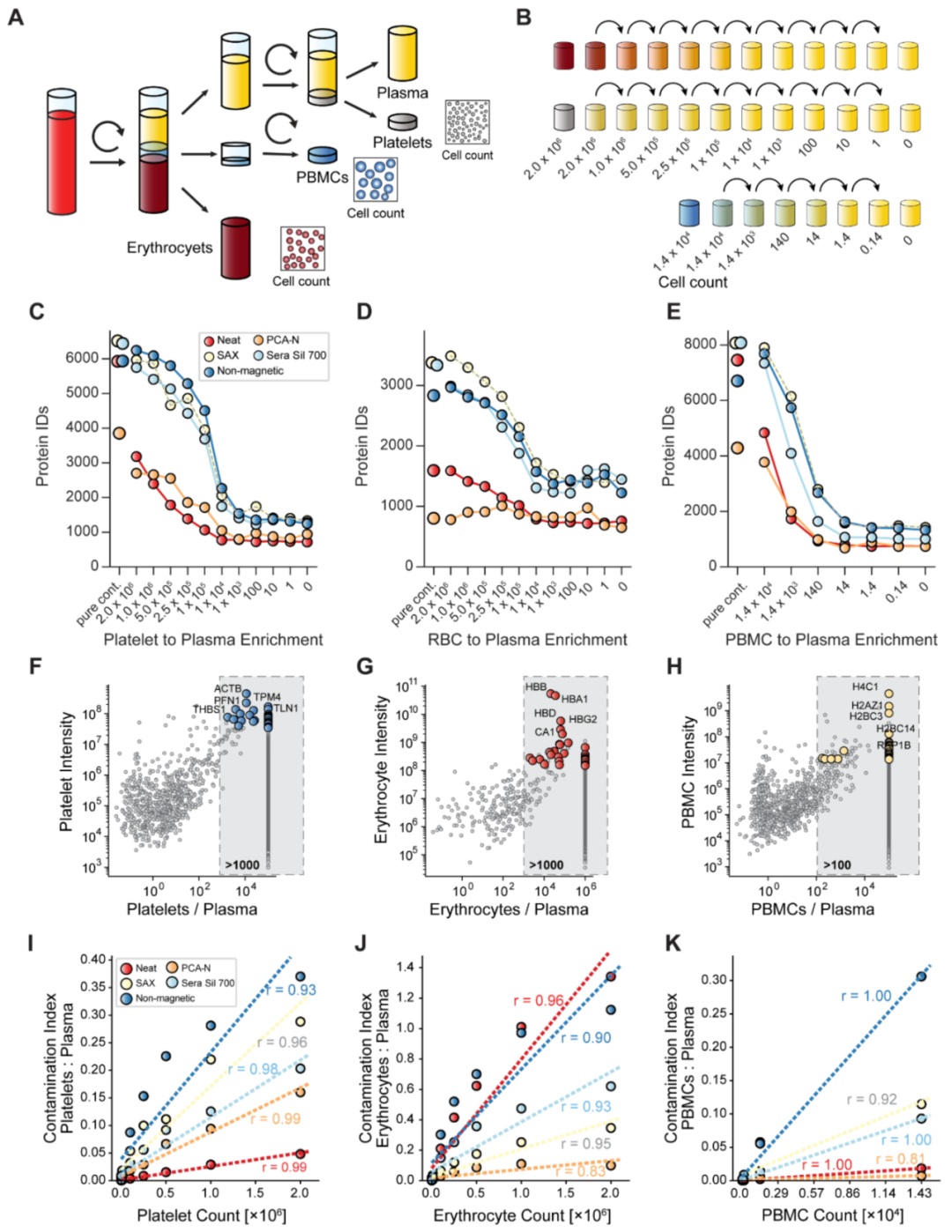
图A是整个实验设计,解释了如何将一份血液样本分成:
- 血浆(Plasma)
-
血小板(Platelet)
- 外周血细胞(PBMCs)
- 血细胞(Erthryocytes,RBC)
- Neat:未经任何蛋白富集方法;
- PCA-N:经过高氯酸沉淀并中和;
- SAX:经过带正电荷的磁性微球(强阴离子交换法);
- Sear Sil 700:经过带硅醇羟基基团的负电荷微球;
- Non-magnetic:经过非磁性(SiO2)微球富集;
2. 三步污染控制策略——通过分析与验证减少污染影响
基于以上结论,为了系统地评估和减少污染对血浆蛋白质组分析的影响,该研究提出了一套“三步污染控制策略”:
单样本污染指数评估:使用经过验证的细胞特异性标志物面板识别和量化样本中不同类型细胞的污染程度,计算每个样本的污染指数。
组间污染差异检测:比较不同组别之间的污染标记物,如果存在显著差异,则需进一步评估污染标志物蛋白与目标生物标志物之间的相关性。
候选标志物与细胞特异性蛋白的相关性分析:计算候选生物标志物蛋白与细胞特异性标志物蛋白之间的相关性,对于相关候选生物标志物进行进一步的验证,如使用独立队列验证。
3. 标准化样本处理流程——规避细胞污染的关键
为了最大限度地减少细胞污染对血浆蛋白质组学分析的影响,文章基于研究结果,提出了以下标准化样本处理流程:
采血管
避免在同一研究中使用不同类型的抗凝剂或采血管,防止蛋白质组学模式的不同增加批次效应和变异性。建议使用EDTA抗凝剂从而在基于磁珠的富集方法中获得最高且最稳定的蛋白质鉴定数量。肝素-Li抗凝剂会引入不同的蛋白质组模式,这可能是由于其对蛋白质结合和凝固的影响。
离心条件
推荐3000g离心30min分离血浆,该条件可最大程度减少所有类型采血管采集的血液的所有三种类型细胞污染,包括血小板、红细胞和PBMC。尤其在使用凝胶分离管时,较低的离心力(例如500g或1000g)下由于凝胶屏障尚未完全形成,会导致涡流效应,从而使细胞物质重新悬浮,增加污染。
从实用的角度评估,建议3000g离心至少7min分离血浆,但需参考三步污染控制策略评估细胞污染影响。
冻融
反复冻融循环会导致蛋白质降解和污染标记物蛋白的释放,推荐将样本分装成小份并在-80°C条件下储存。
4. 拿到血浆蛋白组学数据,一定要警惕!
第一个警惕:警惕你的血浆样本是否存在细胞污染!如何从蛋白组数据检测是否存在污染?Philipp Geyer在2019年有一篇详细的文章,描述了细胞污染评估算法,具体内容可以参考文献(Geyer et al, EBMO Mol Med, 2019)。
第二个警惕:警惕商家过度宣传!尤其是遇到公司宣传能够通过质谱方法从单个样本中检测6000个甚至8000个蛋白,一定要关注是否有很多血小板、血细胞、PBMCs的蛋白。要知道,目前基于NGS的蛋白组学平台 Olink HT,仅能检测3000个左右血浆蛋白。Somalogic 11K宣传能检测11K个血浆蛋白,但是其官网显示其中55%个蛋白未经验证。
第三个警惕:不高迷信蛋白检测数量,稳定性更重要!蛋白检测数量固然重要,但是蛋白鉴定的稳定性更加重要。蛋白检测可能存在很多假阳性,可能尽管检测到了很多蛋白,但是最终得到的蛋白标志物,就是一个假阳标志物。这白白浪费了样本、时间、精力和钱。
厦门普睿迈格生物科技有限公司设计的多磁珠协同前处理血液样本(http://www.purimagbead.com/Product/8096211554.html),充分发挥不同磁珠表面特性结合蛋白的优势,具有结果稳定的特点。
- 上一篇:基于纳米颗粒的血浆蛋白质组学中血液成分污染的系统性评估 2025/5/17
- 下一篇:凝胶色谱填料发展简史 – 背后的产业发展启示 2025/5/17
