使用亲和标签策略表达与纯化重组蛋白的及比较
重组蛋白在科学研究和工业生产中的应用越来越多,不仅局限于普通蛋白,也用于病毒样颗粒等的制备。目前已经形成了多种表达和纯化策略,这些策略旨在改善蛋白质溶解性、对宿主的毒性、低水平表达和纯化困难等问题。
亲和纯化是利用生物分子间的亲和吸附和解离而设计的蛋白纯化方法,具有操作简单、条件温和、获得的蛋白纯度高等特点,特别适合于活性蛋白质的纯化,并且对表达量低的活性蛋白也具有良好的分离效果。重组蛋白的亲和纯化通常是将重组蛋白克隆到含有对固定化树脂具有高度特异性的融合蛋白或肽标记的表达载体中。在许多情况下,融合蛋白或肽也会增加重组蛋白的溶解性,降低对宿主细菌细胞的毒性。但带有亲和标签的重组蛋白也面临一些问题,比如标签有时会对目的蛋白的结构甚至生物活性产生消极影响,这就需要对标签进行去除。
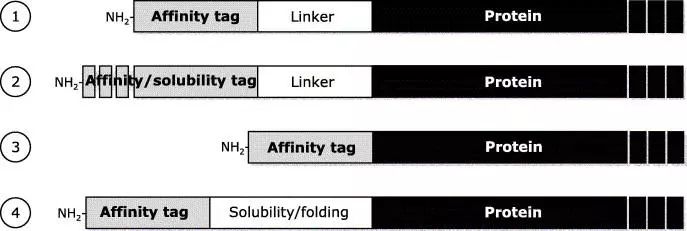
亲和表达及酶切策略
1. 融合表达一个亲和标签及用于纯化后酶切的酶切位点linker
2. 亲和标签既是纯化标签同时也促进目的蛋白的可溶性表达
3. 用于外切酶( TAGZyme)在纯化后从N端切除亲和纯化标签
4.部分促进可溶性表达的序列不带有亲和标签,例如Trx,因此需要额外加上亲和标签
常用的亲和基质包括:专门针对抗体的蛋白A或蛋白G亲和基质,针对生长因子和核酸结合蛋白的肝素型亲和基质,用于纯化含有标签的融合蛋白亲和基质,以及结合了特异性抗体的亲和基质等。随着基因重组表达技术的广泛应用,将目的蛋白与亲和纯化标签进行融合表达,再通过亲和法纯化出目的蛋白,已成为实验室最常用的一项技术。在本文中,我们将总结使用亲和标记来缓解蛋白质溶解性宿主毒性、表达水平及纯化问题这的各种策略,亲和标记去除策略,并讨论蛋白质纯化系统的未来方向。
1.主要的标签种类
主要融合标签的优缺点比较
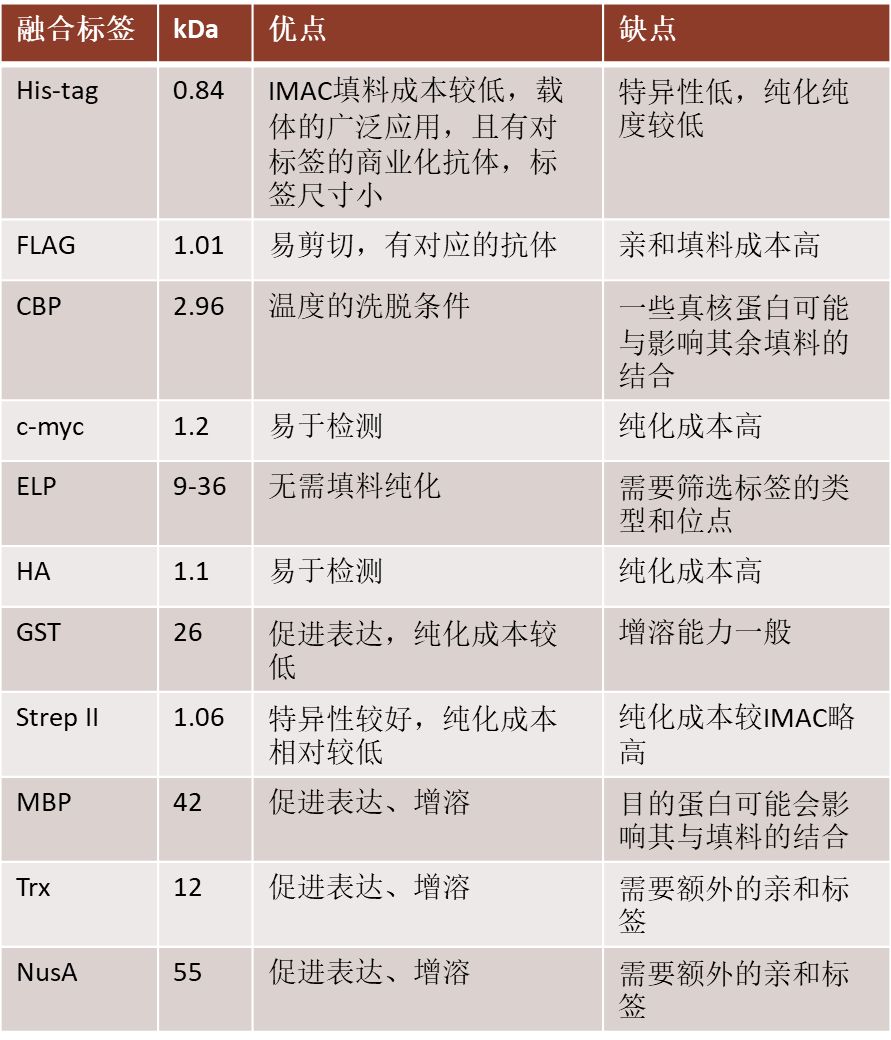
His-tag是目前IMAC最流行的选择,具有尺寸小、洗脱条件温和以及表达载体的广泛适用性的优点。此外,针对His-tag的抗体也可商业获得,可用于识别表达蛋白。因此许多结晶学和核磁共振蛋白研究也采用His-tag。尽管His-tag具有许多优点,但由于细菌裂解液中通常也含有某些金属结合蛋白,这些蛋白也会结合到亲和介质上。因此His-tag纯化的特异性较弱,如果要得到高纯度的目的蛋白,还需要增加纯化步骤。此外,如果样品中含有EDTA等物质,会使填料上的金属离子掉落,极大的影响纯化。金属螯合通常使用IDA或NTA螯合剂,它与Ni2+、Co2+、Cu2+、Fe2+作用,形成带有多个配位基的螯合物,固定在载体上,作为配体吸附对重金属有特异结合能力的蛋白。例如利用基因工程构建带标签的蛋白His(组氨酸)标签融合蛋白,该蛋白对Ni2+等金属离子有高选择的特异性,因此,Ni2+等金属离子能够螯合His标签蛋白并吸附在固相载体上,而其他的蛋白质不能结合或者仅能微弱的结合,从而能够分离纯化目标蛋白。厦门普睿迈格公司生产的PuriMag系列的Ni磁珠(PuriMag Si-IDA-Ni、PuriMag Si-NTA-Ni)对于小量纯化组氨酸标签蛋白,具有快速、实验操作简单的特点,非常适合于实验室小量表达蛋白的纯化验证。
1.2 表位标签用于免疫亲和分离表位标记由含有已知抗原表位的多肽序列组成,且有对其有适当亲和力的特异性抗体。由于利用杂交瘤技术可获得大量、高纯度单克隆抗体,因此可将抗体固定到填料基质上,并用于表位标记重组蛋白的纯化。
1.2.1 FLAG
FLAG标签是由8个氨基酸(DYKDDDDK)组成的一个短肽,分子量很小,高度亲水性,因而不会遮盖融合蛋白中其他的蛋白表位与结构域,也不会改变融合蛋白的功能、分泌或运输。该标签具有天然的亲水特性,很容易定位于融合蛋白的表面,便于利用抗体检测;同时含有一个肠激酶切割位点(DDDK),可以利用肠激酶切除标签。FLAG标签有2个特异性的单克隆抗体,分别为M1单抗、M2单抗。FLAG短肽合成成本较高,不适用于大规模纯化,且需要额外步骤除去结合在层析介质上的短肽。
1.2.2 c-myc
c-myc标签(EQKLSEDEL)已被用于多种用途,如流式细胞术、免疫沉淀以及蛋白质纯化,但纯化已经很少用c-myc标签
1.2.3 HA
流感病毒HA标签包括YPYDVPDYA。和c-myc标签一样,HA标签主要用于示踪,检测和纯化目的蛋白。
抗原表位标记通常被用来代替His-tag标记,因为它们具有更高的特异性和检测能力。然而由于免疫亲和树脂比传统亲和树脂更高昂的成本,使用抗体特异性表位标记进行纯化更适合于小规模纯化。
这些蛋白标签通常比表位标签大,包含能结合至固定在亲和树脂上的特定配体的功能域/序列。
1.3.1 钙调蛋白结合肽(CBP)
CBP是来自骨骼肌肌球蛋白轻链激酶的26个氨基酸序列,在钙离子存在下能与钙调蛋白结合。从钙调素亲和柱中洗脱CBP融合蛋白可以在生理条件下进行,这使得该标签成为难以纯化的蛋白质(如膜蛋白)的一个吸引人的选择。缺点是其他一些真核蛋白可能与钙调蛋白亲和树脂相互作用。因此,CBP标签应该与细菌表达系统一起使用。
1.3.2 谷胱甘肽S-转移酶(GST)
GST标签是一种在真核生物中发现的26kDa酶,能结合到配体谷胱甘肽上。GST标签最初用于pGEX质粒,以促进难以纯化的真核蛋白的纯化。在融合到目标蛋白的N端时,GST标签可能能提高目的蛋白的可溶性及表达程度。GST可能主要通过在聚集和不适当折叠发生前稳定靶蛋白的折叠来改善蛋白质的表达,而不是通过提高溶解性来改善表达。GST(谷胱甘肽S转移酶)标签融合蛋白纯化中,将谷胱甘肽S转移酶与重组蛋白或者多肽链融合,GST标签融合蛋白通过谷胱甘肽S转移酶与固相载体上的还原型谷胱甘肽之间通过酶与底物之间的特异性结合,从而达到和其他蛋白分离的目的。推荐使用PuriMag Si-GSH磁珠快速纯化GST标签融合蛋白。
1.3.3 链霉亲和素结合肽 Strep TagII
链霉亲和素结合标签仅由少数氨基酸组成,并能结合到一种细菌蛋白质链霉亲和素上,用于蛋白在原核表达系统、哺乳动物细胞表达系统等的表达与纯化中。多年来,Streptavidin标签序列从AWRHPQFGG改为NWSHPQFEK。这种新的Strep TagII标签允许将标签放置在N-末端,而不像最初只能在目标蛋白的C-末端。与His-tag相比,StrepII的树脂更贵,但特异性更强,纯化纯度更高,甚至可以与各种免疫树脂相媲美,但相比之下成本显著更低。因此,Strep TagII标签可能是配体标签中最适合大规模纯化的。 Strep-tagⅡ系统的纯化条件比较宽泛,在普通缓冲液下就可与strep-Tactin纯化介质结合,使用2.5mmol/L的脱硫生物素就可将Strep-tagⅡ融合蛋白洗脱下来,螯合剂、去污剂、还原剂 及高达1mol/L的盐均可加入到缓冲液中。此外,Strep-tag Ⅱ在纯化过程中不依赖金属离子,十分适合含金属离子蛋白质的纯化。推荐使用PuriMag Si-StrepTactin磁珠快速纯化Strep TagII标签融合蛋白。
1.3.4 麦芽糖结合蛋白
MBP标签是一种来源于大肠杆菌的42kDa的蛋白,不含 Cys,作为融合蛋白的标签,通常放在 N 端在大肠杆菌中进行表达。MBP 能促进融合蛋白的可溶性表达,尤其对于难表达的真核细胞蛋白,膜蛋白病毒蛋白有很好的促溶表达能力。MBP对交联的淀粉和麦芽糖具有很高的亲和力。然而,MBP融合到重组蛋白的C端可能影响融合蛋白对淀粉/麦芽糖的亲和力,因为融合蛋白可能会和其结合位点相互作用。因此,通常需要在MBP的N-端放置His-tag,以促进融合蛋白的纯化。MBP在提高融合蛋白的溶解性方面也非常有效。 MBP 融合蛋白的纯化在生理条件下进行, 使用麦芽糖进行温和洗脱。推荐使用PuriMag Si-Amylose磁珠快速纯化MBP标签融合蛋白。
1.4.1 弹性蛋白样多肽
ELP由20-330个五肽Val-Pro-Gly-Xaa-Gly重复组成,并通过标签的温度依赖性促进目的蛋白的纯化。根据五肽重复序列的数目和序列,ELP融合蛋白在特定温度下可经历可逆的相变,并从溶液中沉淀出来。这样可以去除上清液中的其他蛋白质,同时分离沉淀的ELP融合蛋白。ELP标签的一个优点是它不需要特殊的树脂或柱,只需离心就可以。然而,由于这一策略利用了融合蛋白的溶解性变化,因此需要考察ELP的类型以及融合的位点,以产生能适当折叠和且具有生理活性的重组蛋白。
1.4.2 硫氧还蛋白A(Trx)
硫氧还蛋白A是一种12kDa的酶,催化各种还原氧化反应。Trx能显著降低目的蛋白形成包涵体的几率。野生型Trx本身并不能通过亲和色谱法进行融合蛋白的纯化。为了解决这一问题,突变的硫氧还蛋白被设计成具有含有组氨酸标签,或在体内易生物素化,然后通过亲和柱捕获。
1.4.3 NusA
NusA是一种55kDa的大肠杆菌蛋白,其在过度表达时具有很高的溶解性,在重组蛋白表达和纯化过程中能增加其融合蛋白的溶解性。与麦芽糖结合蛋白相比,尽管NusA具有非常不同的结构和化学性质,但其溶解性增强效果大致相同。由于NusA与特定的树脂没有很强的结合亲和力,它被设计成具His-tag的表达载体以方便纯化。
以上我们可以总结出,广泛使用的蛋白质结构域标签具有共同的特性:增加了重组蛋白的溶解性和表达水平。这两种增强效应是通过一种目前尚不清楚的机制产生的,因为即使是化学上不同的结构,如MBP和NusA,也可能具有类似的蛋白质表达和溶解作用。有假设认为这些载体蛋白可能作为伴侣促进来目的蛋白质的折叠。
1.5. Protein A亲和层析介质
常用于纯化和分离IgG。Protein A是一种分离自金黄色葡萄球菌的细胞壁蛋白,主要通过Fc片段结合哺乳动物IgG。天然Protein A有5个IgG结合域和许多其它的未知功能域。重组Protein A包含5个高IgG结合域,并去除了其它非主要结合域以降低非特异性结合。 Protein A亲和层析介质已经广泛用于从生物流体或细胞培液中分离纯化各种类型的IgG或者IgG片段。实验已经证明,Protein A和IgG的相互作用仅涉及Fc区域,而不影响Fab片段和抗原的结合。蛋白A、蛋白G、蛋白L、蛋白AG纯化磁珠见如下页面:
http://www.purimagbead.com/Product/7094213318.html
2. 融合标签的去除
在通过亲和力分离纯化目的蛋白后,如果标签的存在将显著影响其生物功能或适用该蛋白的安全性,则需要能够移除这些标签,并且这一操作通常时有必要的。许多策略被设计用来在纯化后去除标签。
常用的标签去除方法及其优缺点
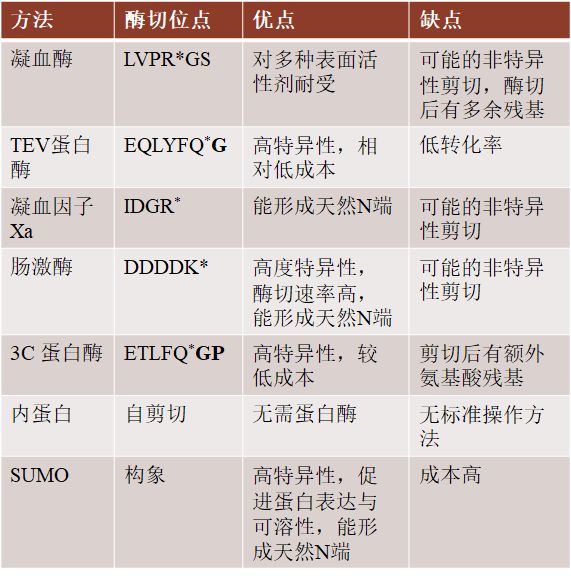
这种37kDa的丝氨酸蛋白酶被广泛使用,通过切割LVPR*GS的凝血酶识别序列,从靶蛋白中去除His-tag和其他标签。尽管凝血酶识别的序列是相对特异的,但有报道称,凝血酶的商业制备会导致非特异性酶切。凝血酶比其他蛋白酶的一个优点是,它能够在多种表面活性剂存在下保持高活性。因此,凝血酶可用于纯化膜蛋白。
2.2 TEV蛋白酶TEV蛋白酶是在烟草蚀刻病毒中发现的一种酶的27kDa的C端催化亚单位。它对序列ENLYFQ*S.具有高度特异性。最初发现经过长时间的培养,该蛋白酶会自我消化。然而,通过对其进行各种突变修改,已可以作为去除标签的工具。研究发现,S219V突变使其蛋白水解酶活性增加了至少两倍,同时也降低了自身降解的敏感性。此外,缺乏C端238-242残基的蛋白酶变体具有更高的表达量和催化活性。TEV蛋白酶的主要缺点是与其他蛋白酶相比转化率较低。其较低的转化率可能解释了其对识别序列的高度特异性,但导致消化时间长和消化所需的蛋白酶量较高。然而一个优势是,识别序列中的丝氨酸可以转变成蛋氨酸,在酶切后能产生一个“天然”的N末端。由于TEV蛋白酶切位点的广泛性和低成本,也是大规模纯化中很好的选择。
3C蛋白酶是一种来源于人鼻病毒的48kDa大小的重组半胱氨酸蛋白酶。与TEV蛋白酶一样,它对其识别序列LEVLFQ*GP具有高度特异性。3C蛋白酶也被设计成含有一个亲和标签,它有助于在裂解后将其从纯化蛋白溶液中去除。主要缺点是酶切后不能目的蛋白不能形成天然N末端。另一方面,与TEV蛋白酶相比,3C蛋白酶在4摄氏度下有10倍以上的活性。
2.4 内蛋白介导的自剪切内蛋白在细菌和酵母菌中发现的能够自我切除的蛋白质,并且已经被改进成为能够在N末端或C末端进行剪切以达到目的蛋白标签去除的目的。例如来自结核分枝杆菌的微小内肽蛋白I-CM突变体已被设计成有利于C末端剪切。当pH值变成6时,C端到I-CM蛋白的序列将被剪切。如果将一个亲和标签融合在内蛋白的N端,目的蛋白在C端,则可在一定条件下实现无标签蛋白的纯化。该系统的优点是不需要使用蛋白酶来切割亲和标签。缺点是必须将蛋白分成两部分进行纯化,以便于纯化后的反式剪切,并且可能留有额外的氨基酸残基。此外在室温下完全剪切需要比蛋白酶剪切更长的时间。由于用于蛋白质纯化的内蛋白种类繁多,目前还没有一个可以应用于各种不同性质的蛋白质的标准或通用方案。
2.5 小泛素相关修饰剂(SUMO)用于蛋白质纯化的最常见的SUMO蛋白酶是Ulp1,一种27kDa的酵母酶,能够将SUMO部分从靶蛋白中去除。与其他识别线性氨基酸序列的蛋白酶不同,SUMO蛋白酶识别其底物的三级结构,因此具有高度特异性。SUMO底物是一个通常在目的蛋白N端加入的用于提高其溶解性和表达的10kDa的蛋白,与MBP水平相当。与其他蛋白酶相比,它的一个主要优势是在2M尿素和高盐浓度的条件下依然具有较高的酶切活性。SUMO纯化系统是一个具有高溶解性、高位点酶切特异性、能产生天然N末端等优势的可靠的蛋白质表达与纯化平台。但缺点是成本相对较高。
3. 常用于稳定蛋白的添加剂
| 类型 | 功能 | 常用试剂 |
| 还原剂 | 防止氧化 | BME |
| DTT | ||
| Tris(2-carboxyethyl) phosphine(TCEP) | ||
| 蛋白酶抑制剂 | 防止内源性蛋白酶分解蛋白 | 亮抑肽酶(丝氨酸和半胱氨酸蛋白酶抑制剂) |
| 抑胃肽(天冬氨酸蛋白酶抑制剂) | ||
| PMSF(丝氨酸蛋白酶抑制剂) | ||
| 金属鳌合剂 | 是金属蛋白酶失活 | EDTA、EGTA |
| 精氨酸激酶 | 稳定蛋白质结构,增强溶解性 | 丙三醇 |
| 去污剂(如CHAPS、NP-40、Triton X-100) | ||
| 糖(如葡萄糖、蔗糖等) | ||
| 离子稳定剂 | 增强溶解性 | 盐类如Nacl、kCI、(NH4)) |
4. 总结
回顾过去几十年为表达和纯化重组蛋白而开发的亲和标签的发展趋势,为了提高纯化效率,已经向使用IMAC进行了重大转移。从2000年起,由于免疫亲和树脂的持续高成本以及其他纯化系统的改进,使用表位标签的研究已经大幅减少。但在需要载体蛋白促进适当折叠、增加溶解性和提高表达水平的应用中,这些标签的使用仍然是有价值的,有时是必要的。考虑到这一需要,在选择蛋白质纯化的亲和标签和去除标签的工具方面有了许多不同的方法。在过去15年中,载体蛋白与高亲和力结合的IMAC标签的结合使用有了越来越多的趋势。未来的趋势是使用与高可溶性载体蛋白的N端融合的小分子的亲和力标签,促进目的蛋白的折叠、溶解、表达和纯化,并进行柱上的纯化及酶切位点的去除。
更多蛋白纯化磁珠见 http://www.purimagbead.com/Product/Proteinextract/
- 上一篇:恭喜客户采用我司链霉亲和素磁珠(PuriMag G-Stre 2019/10/13
- 下一篇:恭喜客户采用我公司氨基磁珠在《Talanta》期刊发表SCI 2019/9/10

