一文读懂 DNA pull-down 技术
在前面的文章中我们和大家一起学习了RNA pull-down这种实验技术,好学且好奇心强的小编又很快发现一种和它挺像的叫做DNA pull-down的新技术,再一起来看看吧。
一、原理概述
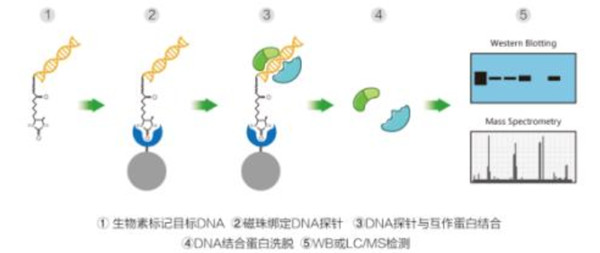
DNA pull-down是体外研究DNA与蛋白互作的有力工具。体外制备生物素标记的靶DNA系列,使其与待测蛋白液孵育,形成“生物素化DNA-蛋白质”复合物。由于生物素与链霉亲和素间的作用是目前已知强度最高的非共价作用之间,因此采用链霉亲和素磁珠将靶DNA及其结合蛋白从待测蛋白液中分离出来。通过western blot实验检测洗脱液中是否有待测蛋白,通过LC-MS/MS技术检测靶DNA的潜在结合蛋白(如具体某个或某些转录因子/组蛋白等)。
二、实验流程
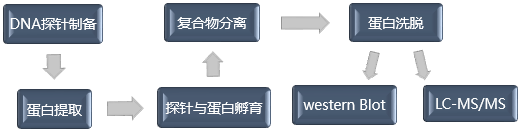
一般来说,该实验首先,需要针对待研究目的基因的调控区域设计并制备特异性探针(以脱硫生物素标记为主流);同时,制备细胞核提取物;将探针和核提取物共同孵育,DNA结合蛋白就会和靶向序列特异性结合;然后,通过亲和素磁珠纯化蛋白质DNA复合物;最后针对获得的蛋白,使用western blot验证或者质谱方式鉴定蛋白质类型。
优点:
① 富集分析低丰度蛋白;
② 探针制备简便,周期短;
③ 获得特异性蛋白与下游蛋白质检测技术兼容;
缺点:
① 长连探针往往存在非特异结合现象;
② 反应条件要求无核酸酶;
③ 体外实验,相对体内实验存在一定弊端;
以下为参考实验流程,不同实验室会有细微差异:
1.探针设计及标记
(1)采用基因组DNA做模板,经PCR扩增启动子片段;
(2)将其克隆至克隆载体,并测序鉴定成功;
(3)使用PCR法或末端标记法标记探针;
(4)标记的探针利用凝胶回收试剂盒纯化回收探针,并检测探针浓度;
(5) -20℃保存,待用;
2.Pull down
(1) 预先混合 5µg 生物素标记的 DNA 和 500µg 核蛋白,置于冰上;
(2) 取 100µl 链霉亲和素磁珠(PuriMag G-strep),用冰冷 PBS 洗一次,5000g 离心 30 秒;
(3) 将 DNA 与蛋白的混合物加到磁珠中,重悬磁珠;
(4) 4℃孵育 1 小时;
(5) 5000g,离心 30 秒,去除上清,收集沉淀;
(6) 用冰冷 PBS 洗磁珠三次,5000g 离心 1 分钟,尽可能去除上清,收集沉淀;
(7) 加入 30µl 蛋白上样缓冲液,重悬沉淀,沸水煮 10 分钟,
3.蛋白质检测-- western blot
(1) 电泳:实验采用不连续系统蛋白质SDS-PAGE,浓度为5%浓缩胶和8~12%浓度分离胶;每孔上样40~60ug总蛋白,开始电压为100v,到达分离胶后调为120v;
(2) 转膜:转膜为恒流转膜,电流为200mA,时间根据目的蛋白分子量选择60~120min。
(3) 封闭:蛋白膜放置到TBST溶液中,漂洗1-2分钟,以洗去膜上的转膜液;加入5%脱脂奶粉封闭液,室温50rpm,封闭60分钟。
(4) 孵育一抗:根据蛋白Marker指示将PVDF膜剪开,参考一抗浓度;将PVDF膜分别放入含各自一抗溶液中,4度孵育一抗过夜,然后放入TBST洗涤液,摇动洗涤3次,每次15min。
(5) 孵育二抗:参考二抗浓度,按比例稀释辣根过氧化物酶(HRP)标记的二抗。将PVDF膜加入稀释好的二抗,室温摇动孵育1h;放入TBST洗涤液,摇动洗涤3次,每次15min。
(6) 显色:使用化学发光试剂,黑暗处显色,用X光片压片,显影液及定影液洗片。
4.蛋白质检测-- MS
(1) 切胶:用刀片切取胶粒(胶粒直径1-2mm),置于1.5ml EP管中。
(2) 清洗:用200ul MilliQ震荡清洗2次,每次10分钟。
(3) 脱色:对于考染胶,加考染胶色液(25mM NH4HCO3, 50% ACN)200ul,37℃ 20分钟或超声脱色5分钟,吸干,重复脱色2-3次,至蓝色褪去。
(4) 脱水:加ACN 100ul脱水至胶粒变白,吸弃ACN。
(5) 清洗:用200ul MilliQ震荡清洗2次,每次10分钟;然后用200ul 50% ACN震荡清洗2次,每次10分钟。
(6) 脱水:加ACN 100ul 脱水至胶粒变白,吸弃ACN。
(7) 用25mM NH4HCO3稀释Trypsin 至12.5mg/ml,每管加10ul,稍微离心一下,让酶液与胶粒充分接触,4℃放置30min ,待酶液被胶粒完全吸收,吸弃多余的酶液,加25mM NH4HCO3 20ul,37℃过夜(16h)。
(8) 质谱样品使用德国Bruker公司的Ultraflex III质谱仪开展分析,参数设置:反射模式;
(9) 离子源加速电压1为24kv;
(10) 加速电压2为22kv;
(11) 离子延迟提取0.000ns;
(12) 真空度1.4×10-7 Torr;
(13) 质谱信号单次扫描累加200次;
(14) 使用标准Maker峰作为外标校正质谱峰,正离子谱测定,测定范围控制在700-4000;
(15) 样品的肽质量指纹图谱,胰酶自降解峰和污染物质的峰自动剔除;
(16) 利用LIFT软件将PMF强度最大的5个峰进行串级质谱分析(峰强度大于300)。
DNA-pull dwon模式图如下所示:
三、结果示意图:
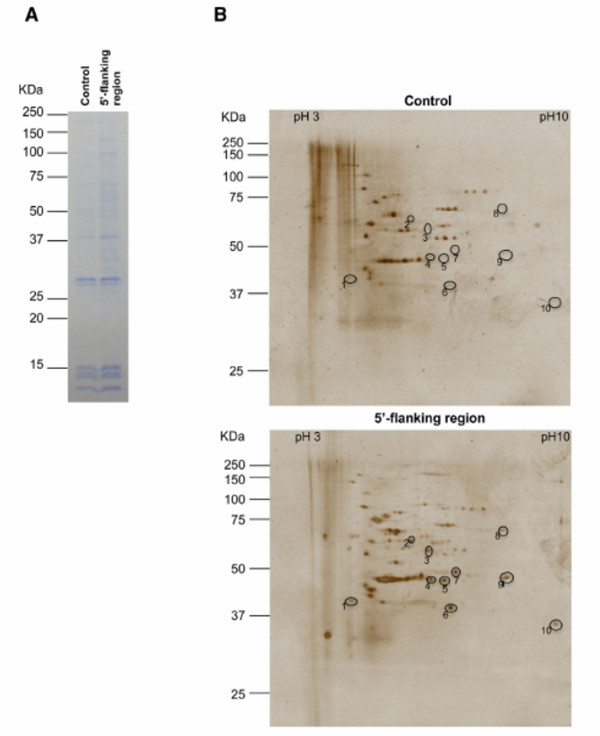
额,好像跟RNA pull-down确实很像,就是RNA换成了DNA,检测的对象就变成了DNA与蛋白的互做。那么它有哪些应用呢?
四.技术应用
核酸与蛋白质的互作是细胞功能的核心,包括蛋白质合成、mRNA组装等生命活动中重要的代谢过程,研究核酸与蛋白质的互作是研究生命科学的基本工具。DNA pull-down主要用于目的DNA片段的互作蛋白(如转录因子等)筛选。
五、DNA pull down常见疑点解析
Q:1. 适配子DNA单链,可以用带有互补链的磁珠进行pull down吗?如果可以,效率怎么样?一般需要怎么优化条件?
A:理论上说,若DNA单链能够与磁珠上的互补链杂交成功,是可以进行pull down实验的; 效率如何不好确定,这个取决于两条DNA单链是否能杂交成功、蛋白-DNA结合的强弱、蛋白的丰度等。
Q2: DNA pull down的 原理?
A:针对目标区域设计特异性DNA探针并进行生物素标记,生物素探针可与偶联在磁珠上的链霉亲和素结合;细胞蛋白提取物与磁珠-DNA探针孵育,从而钓取与DNA探针有特异性结合的互作蛋白质。
Q3: 你们对外服务的检测项目有哪些?
A:细胞、动物/植物组织、菌体都可以做DNA pull down, 我们还可以做的检测实验具体如下:
(1) RNA-蛋白/RNA互作及定位:RNA pull down、RIP、fish等;
(2) DNA-蛋白互作:DNA pull down、ChIP、EMSA、双荧光素酶、酵母单杂等;
(3) 蛋白-蛋白互作:GST/his pull down、CoIP、酵母双杂等;
(4) 细胞学检测:细胞增殖-MTT/CCK-8, 细胞凋亡, 细胞周期,细胞迁移、侵袭:划痕愈合/Transwell/Transwell(Matrigel)等;
(5) 外泌体服务:提取、鉴定(Nanosight粒径检测/电镜/WB)、测序(miRNA/lncRNA)、蛋白质组学;
(6) 转录组及蛋白质组:真核有参转录组、无参转录组、真核lncRNA、small RNA等。
Q4:效率有多高?
A:效率主要取决于蛋白-DNA结合的强弱、蛋白的丰度等。
Q5:老师,对照组的DNA序列是怎么选择的?
A:一般对照组是没有探针的,对照组是磁珠beads+蛋白。
Q6:DNA pull down有什么缺陷吗?
A:DNA pull down-MS是体外研究蛋白-DNA是否有直接互作的经典技术,是将探针结合在凝胶/磁珠上,钓取与DNA探针有互作的蛋白;就技术而言,没有明显的缺陷;后续质谱能鉴定到多少蛋白取决于蛋白-DNA结合的强弱、蛋白的丰度等。
Q7: 做DNA pulldown 用DNA单链好还是双链好?
A:常规的是用DNA双链作为探针。
Q8: 可以简单讲一下生物素标记引物的原理吗?
A:主要利用生物素(biotin)和亲和素(avidin)这两种分子的独特性质; 亲和素的每个亚基都能结合一个生物素分子,两者的结合是通过生物素的脲基环部分完成的;因此可将其戊酸侧链通过酰胺键与核酸分子相连,构成生物素标记的核酸探针。
Q9: 如果做转录因子,转录因子和DNA结合发起转录,不应是和打开的单链结合吗?
A:启动子是位于转录起始位点(结构基因)5'端上游的DNA序列,就像"开关",决定基因的活动,本身并不控制基因活动,而是通过与特定蛋白质(转录因子)结合而控制基因的活动。转录因子就像一面"旗子",指挥着酶(enzymes)(RNA聚合酶polymerases) 的活动,这种酶制造着基因的RNA复制本。转录因子是与启动子DNA双链结合的。
Q10:做100bp突变对照组应该怎么突变碱基?
A:可以通过查找相关资料确定启动子发挥功能的核心区域,将核心区域进行突变;一般是A/G互换,C/T互换突变。
Q11: DNA互补链可以相互钓取吗?
A:DNA pull down 是研究蛋白-DNA的互作,不可以用DNA互补链相互钓取。
Q12:请问DNA为什么会与蛋白质互作呢,它们有什么功能的联系吗?
A:DNA pulldown 是研究蛋白-DNA的互作, 主要应用于寻找已知的启动子序列所结合的未知蛋白(转录因子);启动子是位于转录起始位点(结构基因)5'端上游的DNA序列,就像"开关",决定基因的活动,本身并不控制基因活动,而是通过与特定蛋白质(转录因子)结合而控制基因的活动。
Q13: 如果做小肽对细菌的作用是否也可以DNA pull down?
A:小肽属于蛋白类, 做不了DNA pull down。
Q14:未加探针的对照组鉴定出蛋白是什么原因呢?
A:对照组是磁珠beads+蛋白,虽然没有探针,但少量蛋白可以与磁珠相结合,对照组鉴定到的蛋白是非特异性的背景蛋白。
用于pull-down的链霉亲和素磁珠请参考:
http://www.purimagbead.com/Product/8271042221.html (200nm链霉亲和素磁珠)
http://www.purimagbead.com/Product/9728163513.html (1um链霉亲和素磁珠)
- 上一篇:客户采用我司链霉亲和素磁珠(PuriMag G-Strep) 2021/4/24
- 下一篇:IVD 诊断技术的优缺点综合比较 2021/3/9

