临床糖蛋白质组学研究方法综述
3.4 肾脏疾病
3.4.1 IgA肾病
IgA肾病(IgAN)的机制尚不明确,但目前的研究表明,血清中缺乏半乳糖的IgA1(Gd-IgA1)水平升高在其发展中起着重要作用。此外,补体系统的激活可能有助于免疫复合物的病理性积累。图6A简洁地说明了IgAN与糖基化过程之间的联系。在一项综合审查中,分析了22项研究的分析数据,以评估Gd-IgA1的水平。发现显示,与健康对照组相比,IgAN患者的血清中Gd-IgA1的浓度显著升高(p < 0.00001)。
IgA1和IgA2是IgA家族的重要成员,它们是糖蛋白。值得注意的是,与健康对照组相比,IgAN患者的血清中Gd-IgA1的浓度显著升高,这与Gal和/或唾液酸(NeuAc)水平降低和GalNAc水平增加有关。此外,IgA2已被证明能更大程度地释放中性粒细胞胞外陷阱,从而增加触发炎症的能力。
糖蛋白质组方法对于探索来自人类尿液样本的糖蛋白的改变至关重要,这为异常糖基化提供了见解。Dotz等人的一项显著研究27比较了83名IgAN患者和244名健康对照者的尿液样本。该比较旨在检测IgA1和IgA2的N-或O-糖基化的变化。LC–MS分析揭示,肾小球功能的变化与N-糖基化过程的多样性和复杂性密切相关。具体来说,IgA1的异常O-糖基化对肾小球功能有负面影响,糖肽水平是预测IgAN发作的精确指标。糖蛋白质组技术的进步还使研究人员能够识别上调或下调的糖蛋白,为开发新的评估肾小管功能的诊断工具铺平了道路。例如,研究人员发现了11种尿液糖蛋白在IgAN患者中独特存在。这些糖蛋白可以作为未来医疗实践中的潜在诊断生物标志物。同样,自动三明治免疫分析系统已被用于准确测量糖基化IgA1的产生。使用毛花荚豆凝集素(WFA),它特别结合末端GalNAc,允许识别异常糖基化的血清IgA1。这种方法采用WFA在三明治免疫分析格式中与化学发光酶免疫分析系统一起,为糖链分析提供了可靠的方法。Yu等人报道IgAN患者IgA1铰链区GalNAc水平较低与疾病的不同亚型相关。通过LC–MS/MS对纯化的聚合物IgA1进行分析,发现Crescent IgAN患者的GalNAc3和GalNAc4水平显著高于健康个体。相反,GalNAc5和GalNAc6在Crescent IgAN患者中最低,在非Crescent IgAN患者中略高,在健康个体中最高。317在2001年,Nakazawa等人使用MALDI–TOF–MS检查了278名IgAN患者的290个肾活检样本中的IgA1,以及4个血清IgA1样本。他们的发现显示,由于O-糖链碳水化合物的存在较低,循环血清IgA1的重量较低。同样,Nakazawa等人报告说,O-糖基化(GalNAc和Gal)的降低可能是IgAN发展的一个关键因素。进一步的研究揭示了IgA1铰链区O-糖基化在三组中的表达变化:健康对照组、非IgAN患者和IgAN患者,使用IgA亲和珠评估这些生物标志物的诊断可靠性。结果表明,IgAN患者的GalNAc水平显著较低,表明其可能是该病状的有效生物标志物。
如上所述,异常O-糖基化的IgA1被IgG识别,并以独特的方式结合。这种相互作用表明,从IgAN患者中分离IgG并引入Gal-IgA1可以促进免疫复合物的形成。支持这一假设的是,使用特定的IgG和Gal-IgA1在糖链依赖性方法中成功产生了免疫复合物,这对于评估疾病的进展至关重要。此外,糖基转移酶在O-糖基化过程中起着关键作用。一项特定研究使用LC–MS探索了糖基转移酶酶活性与IgA1上O-糖链生物合成之间的相关性。这项研究主要评估了多肽N-乙酰半乳糖胺基转移酶反应及其产物。这项调查通过连续的碳水化合物添加模拟了O-糖基化过程,突出了特定糖基转移酶的关键介导作用。
总的来说,最近的发现主要集中在O-糖基化蛋白的减少作为揭示IgAN进展的关键生物标志物上。对临床样本的统计分析揭示了相关性,但这些独特表达的糖蛋白,以及其他可能异常表达的糖蛋白(如补体系统中的糖蛋白)对IgAN发作的贡献机制仍不清楚。
3.4.2 糖尿病肾病
糖尿病肾病(DN)是由长期高血糖引起的继发性损伤,是医学界的一个重大挑战。这种状况以肾脏的继发性损伤为特征,主要由微炎症和细胞外基质的扩张驱动,两者都因血糖水平升高而加剧。现代研究人员在准确检测非白蛋白尿等疾病和开发精确靶向治疗方面遇到了重大障碍。因此,科学焦点转向了糖尿病糖蛋白的研究,为诊断和干预提供了有希望的途径。这一探索有潜力彻底改变我们管理糖尿病肾脏损伤的方法,标志着在对抗DN的斗争中向前迈出了关键的一步。使用二维差异LC–MS/MS(2D-LC–MS/MS)以及同位素标记标签用于相对和绝对定量,检查了2型DN不同阶段的糖蛋白变化,包括正常对照组、正常白蛋白尿、微量白蛋白尿和大量白蛋白尿。这项全面研究鉴定了408种独特的糖蛋白。具体来说,分析揭示了在正常白蛋白尿组、微量白蛋白尿组和大量白蛋白尿组中分别独有的72、107和123种糖蛋白。当前研究的发现表明,细胞死亡和凋亡在微量白蛋白尿组和大量白蛋白尿组中显著触发。值得注意的是,在大量白蛋白尿组中,急性期蛋白如丝氨酸蛋白酶抑制剂家族A成员1(SERPINA1)、CP和甲状腺素运载蛋白的水平显著增加。这种增加表明肾脏中发生了炎症和纤维化。这种趋势指向了这些糖蛋白作为肾脏状况诊断的新生物标志物的潜力。324另一项研究旨在区分正常和糖尿病小鼠肾脏中的N-糖蛋白质组。为了实现这一目标,通过使用胰岛素治疗的db/db小鼠建立糖尿病模型以诱导2型糖尿病,以及使用链脲佐菌素(STZ)处理的小鼠以诱导1型糖尿病。N-糖基化谱的调查揭示了两种类型的糖尿病之间的显著差异。尽管某些糖蛋白,如HbA1c,在两种模型中都显示出类似的增加,但整合素-β1显示出不同的模式,在STZ诱导的糖尿病小鼠中增加,在db/db小鼠中减少。相反,SGLT1显示出相反的效果。325此外,锌α2-糖蛋白(ZAG)被确定为2型糖尿病患者早期肾脏损伤的关键生物标志物。它在尿液和血清中的显著升高表明ZAG有潜力预测早期DN,特别是在无白蛋白尿的阶段。这一点由其与估计的肾小球滤过率的负相关性所强调。因此,ZAG可能是非白蛋白尿DN的新生物标志物。此外,使用SNA斑点分析的研究发现,在DN患者的尿液中显著存在Sia α2-6 Gal/GalNAc。此外,这种糖链模式的水平与DN的进展直接相关。肾小球内皮细胞表面的完整性对于防止白蛋白泄漏至关重要。研究表明,蛋白多糖,即附着在一个或多个糖胺聚糖链到核心蛋白的蛋白质,对于维持肾小球内皮细胞表面的完整性至关重要。这是通过在管腔细胞表面形成一层来实现的。图6B简洁地总结了与DN中糖基化相关的发现。当前研究为早期DN的预测提供了初步见解。然而,这些研究中使用的样本量仍然不足以得出明确结论。此外,这些糖蛋白的具体生物学功能仍不清楚,这突显了需要进一步研究以阐明它们的作用。
3.4.3 膜性肾病
大多数人认为原发性膜性肾病(PMN)或特发性膜性肾病(IMN)是一种肾脏特异性的自身免疫性肾小球疾病,其特征是尿蛋白增加和持续的肾小球损伤。它通常是由针对M型磷脂酶A2受体(抗-PLA2R)的抗体引起的,导致自身免疫复合物在肾小球中的积累,包括补体。332,333此外,在免疫荧光染色下,可以观察到IgG(特别是PMN中的IgG4)在上皮下位置的细小颗粒状沉积,并伴随着足细胞足突的丢失。图6C总结了与MN中糖基化相关的可能发病机制。研究发现,IgG4的糖基化改变在PMN的进展中起着作用。来自PMN患者的血清中含有IgG4,已被证明可以触发足细胞蛋白突触蛋白和与nephrin相关的蛋白1的蛋白水解,破坏足细胞细胞骨架的结构。此外,抗-PLA2R1 IgG4以糖基化依赖性的方式能够与甘露糖结合凝集素(MBL)结合,从而激活凝集素补体途径,随后损伤足细胞。这一见解为PMN治疗开辟了新的途径,特别是针对和阻断凝集素途径。此外,基于MN与PLA2R之间的强相关性,一项研究利用一种称为超快速糖蛋白固定化用于糖链提取的N-糖链纯化技术。这种方法揭示了在PLA2R1阳性IMN组中,唾液酸化和核心岩藻糖基化上调,而半乳糖基化下调。基于这些发现,分析引入了一个六糖链标记面板(H4N3S1、H4N3F1、H6N4S2、H6H5F1S2、H6N5、H6N6F1S1),这有助于诊断与PAL2R1相关的IMN患者。337,338图6C提供了MN中糖基化的发现的简洁概述。与IgAN和DN相比,与MN相关的发现显著较少。一个原因是对这种疾病的机制研究不足。没有针刺活检,对临床医生来说,实现准确诊断和治疗是一个挑战。同样,病理学家在病理水平上也面临诊断困难。因此,必须将更多的工作投入到这一领域,并确定额外的生物标志物,以减轻诊断的挑战。总之,临床糖蛋白质组学领域在理解CKD方面取得了显著进展。尽管取得了这些进展,但前进的道路充满了挑战和未回答的问题。大多数糖蛋白质组学研究集中在比较CKD样本。这一策略在发现不同肾脏疾病的潜在生物标志物方面至关重要。然而,这些生物标志物的临床相关性仍然不清楚。一个主要问题是研究人群中的变量可能会扭曲结果,影响发现的可靠性。此外,糖蛋白与CKD之间的因果关系在很大程度上尚未探索。这一知识空白对糖蛋白的临床意义投下了阴影,这些糖蛋白在患者中要么过表达,要么表达不足。此外,虽然糖蛋白质组数据可以从全基因组研究中产生,但由于缺乏全面的数据集,整合这些数据的挑战仍然存在。这一限制阻碍了进行彻底分析的能力,这些分析可能会揭示更深入的疾病机制见解。另一个需要考虑的关键方面是通过血液和尿液测试分析糖蛋白引入的空间异质性。这种方法可以窥见特定器官中发生的变化,但不能提供全身变化的完整图景。孤立地看待疾病可能会阻碍我们对其进展和对全身影响的理解。越来越多的人认为,将额外的临床生物标志物,如肾脏损伤分子-1(KIM-1)、β-Trace蛋白、中性粒细胞明胶酶相关脂蛋白和N-乙酰-β-D-葡糖胺苷酶结合起来,可以提高诊断准确性。此外,一些专家正在结合基因组学、蛋白质组学、转录组学、代谢组学和糖蛋白质组学,这些是基于分子机制的,以帮助CKD的临床诊断,并建立特定的分类和治疗。尽管我们已经识别了许多促进亚型识别的分子,这些分子通过较少侵入性的检查,但缺乏准确的亚型诊断标准。因此,至关重要的是发现新的生物标志物,阐明它们的相互作用,建立它们与这些机制的联系。值得注意的是,所有这些技术都旨在实现精确诊断和改进的靶向治疗策略。总之,在临床糖蛋白质组学领域,解决当前挑战和填补现有知识空白是至关重要的。
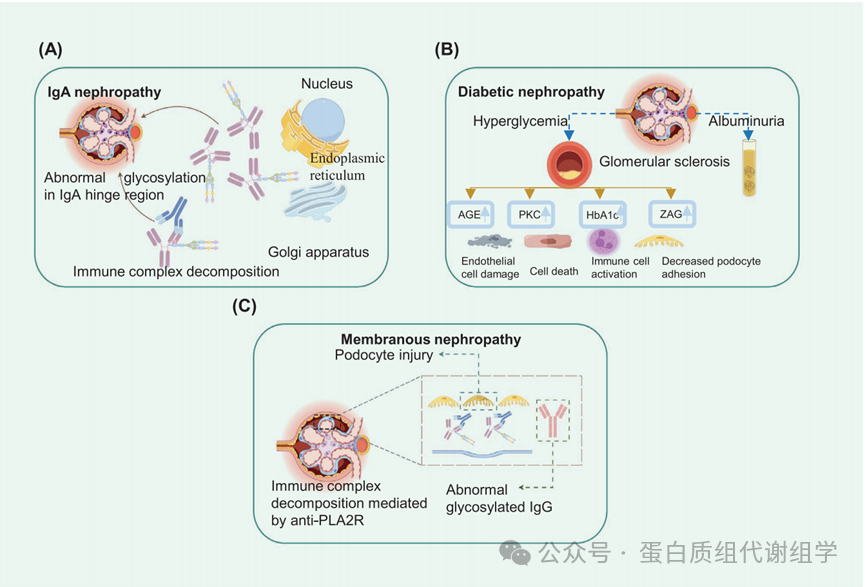
图6:异常糖蛋白的表达与IgA肾病,糖尿病肾病和膜性肾病的关联与机制
- 上一篇:糖肽和糖蛋白分离富集方法精要必看 2024/11/9
- 下一篇:磷酸化蛋白/磷酸化肽段富集与分离方法研究最新进展 2024/11/9

