组氨酸标签蛋白纯化磁珠,His-tag蛋白纯化的理想选择
蛋白质表面的一些氨基酸,如组氨酸、色氨酸、半胱氨酸等能与多种金属离子(Ca2+、Mg2+、Ni2+、Co2+等)发生特殊的相互作用,这些作用包括配位结合、静电吸附、共价键结合,其中以配位结合为主,而且这其中又以His-Tag标签成为蛋白纯化的首选标签。在重组蛋白末端融合多个组氨酸成串的肽段,凭借其与二价金属离子的螯合作用,从而利用亲和作用纯化蛋白。
传统的His-Tag蛋白多利用金属螯合亲合层析柱进行层析分离。磁性纳米粒子作为一种新型的介质,利用其在磁场下可快速分离的特点,通过在磁珠表面螯合Ni2+离子,进而将其用于His-Tag蛋白的纯化,具有速度快、容易放大、可自动化操作等诸多优点。His-Tag蛋白通过磁性介质进行分离纯化的一般流程是裂解、吸附、洗涤、洗脱四个步骤,即可获得高纯度的目标蛋白。
对比传统的过柱层析纯化方式, His-tag Protein Purification磁珠通过磁性分离方式纯化组氨酸标签蛋白,无需对粗蛋白样品进行多次费时费力的离心、过滤步骤,无需装柱和过柱层析,无需昂贵的柱层析设备,在1小时内便能便捷地获得高产量和高纯度的目的蛋白,且能轻松实现多样品平行处理,显著提高了工作效率,大大降低了设备、时间和人工成本。
普睿迈格生物科技有限公司,通过独有的技术开发了一系列具备不同特性的PuriMag™ Ni系列磁珠,基于硅基的超顺磁性纳米粒子,大大降低表面的非特异吸附,进而通过不同螯合基团修饰的镍离子 (Ni2+),特异性地分离His-tag蛋白。 该磁珠专为携带组氨酸标签的异源表达蛋白纯化所设计,对于大肠杆菌、酵母、昆虫细胞和动物细胞表达的组氨酸标签蛋白,均有优异的纯化性能。
PuriMag提供三种不同螯合方式的硅基Ni磁珠,可根据您的需要,自主选择最合适的分离磁珠,为您获得高纯度蛋白提供助力。
(1)IDA镍磁珠——PuriMag Si-IDA-Ni
IDA 通过双羧基螯合Ni,结构较为简单,结合容量较高,成本相对低廉,但表面的Ni容易被其它小分子破坏,重复利用效果相对较差,但再生后重复利用较容易。
更多IDA镍磁珠请参考产品页: http://www.purimagbead.com/Product/320781945.html
(2)NTA镍磁珠——PuriMag Si -NTA-Ni
NTA螯合Ni磁珠是非常稳定的八面体结构,Ni位于结构的中心,可以保护竞争性小分子对Ni的进攻,因此结构更稳定,可以耐受一定浓度还原剂、变性剂、去污剂等各种小分子对Ni的影响。
更多NTA镍磁珠请参考产品页: http://www.purimagbead.com/Product/1786041317.html
(3)TED镍磁珠——PuriMag Si -TED-Ni
TED螯合Ni磁珠是另外一种较非常稳定的八面体结构,Ni位于结构的中心,可以保护竞争性小分子对Ni的进攻,因此结构更稳定,能更好的耐受还原剂、变性剂、去污剂等各种小分子对Ni的影响。
更多TED镍磁珠请参考产品页: http://www.purimagbead.com/Product/1953281313.html
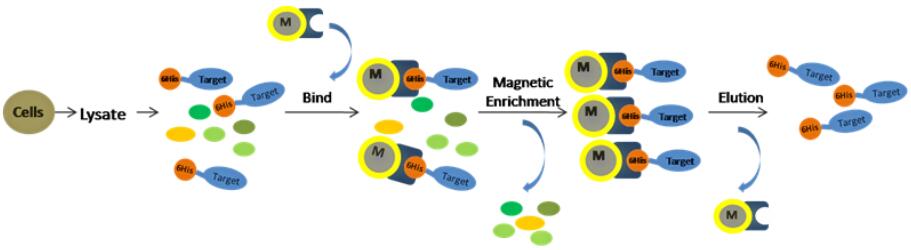
图1 磁珠法快速纯化组氨酸标签蛋白流程
- 上一篇:链霉亲和素(streptavidin,SA)与亲和素(avi 2018/2/8
- 下一篇: His 标签纯化常见问题|组氨酸标签蛋白磁珠纯化常见问题 2018/1/27
